背景
IgG同种型治疗性单克隆抗体的Fc区常通过工程化改造,以优化其药理学和药代动力学(PK)特性,同时安全性也是开发的关键考量。Fc的工程化改造能够增强抗体的效应子功能(如抗体ADCC、ADCP、CDC)主要涉及提高Fc区与激活型FcγR或补体成分C1q的结合能力。此外,通过特定氨基酸取代增强Fc-Fc六聚化或FcγRIIB相互作用,可实现基于受体成簇的激动活性。另一方面,降低FcγR和C1q结合则可实现Fc结构域的(部分)“沉默”。Fc结构域的多聚化也是阻断Fcγ受体(FcγR)和新生儿Fc受体(FcRn)的有效策略。

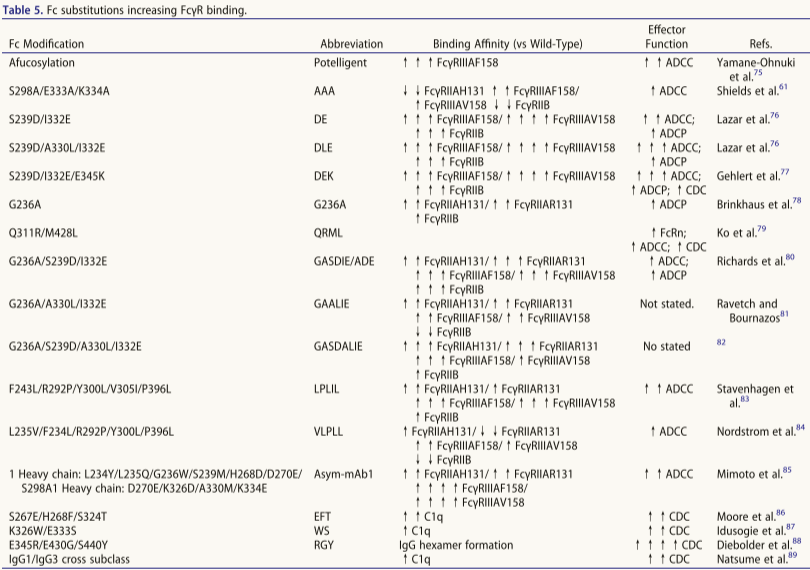
2025年7月7日,Brennan教授的研究团队在mAbs vol上发表了一篇名为“Impact of antibody Fc engineering on translational pharmacology, and safety: insights from industry case studies”的文章,文章详细介绍工程化Fc区以实现期望的药理学和药代动力学是药物开发中广泛采用的策略。Fc区可以通过氨基酸取代和糖工程改造进行修饰,导致增强或降低的效应子功能,优选与FcR亚型的免疫结合,或与FcRn的pH依赖性结合。mAb的结合和效应物活性的这些改变也可能潜在地伴随着不期望的作用或安全性问题。对于Fc修饰的mAb,体外和体内非临床药理学和安全性模型的选择需要考虑FcR表达和功能的种属差异、Fc修饰在人体与非临床种属中的潜在差异效应、靶向和同源配体表达模式的影响以及针对mAb的新出现的抗药抗体的潜在影响。
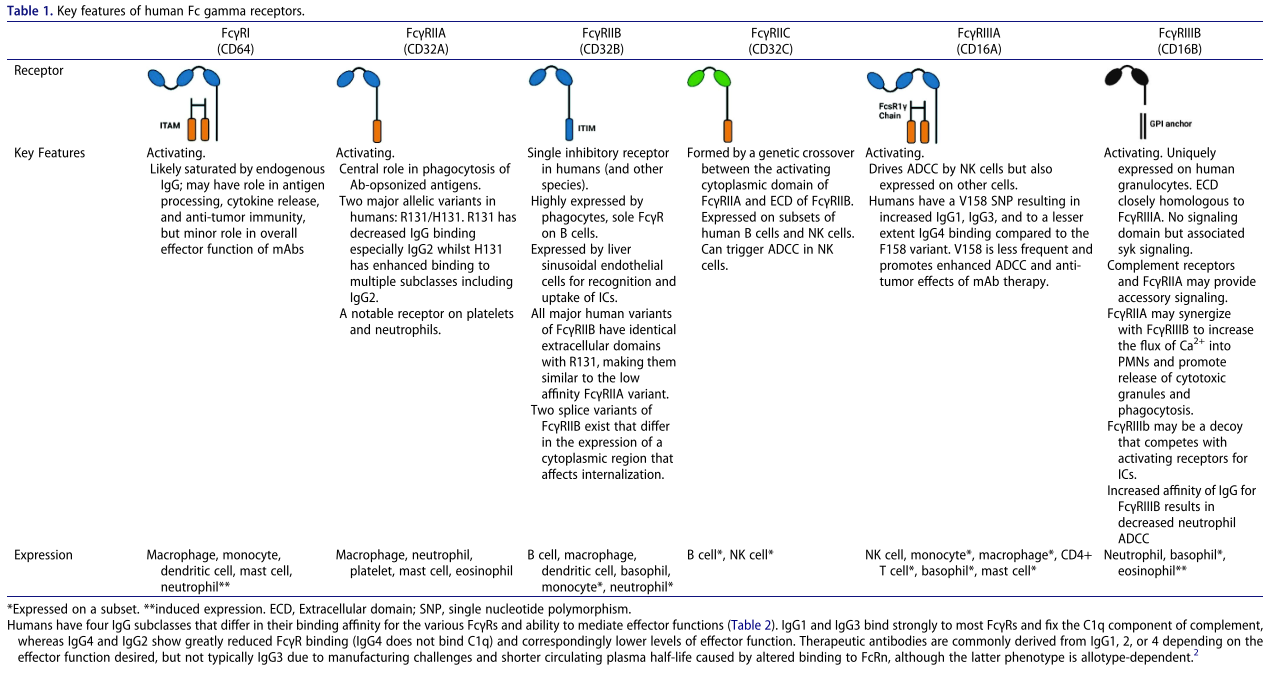
FcγR在人体中的表达和功能
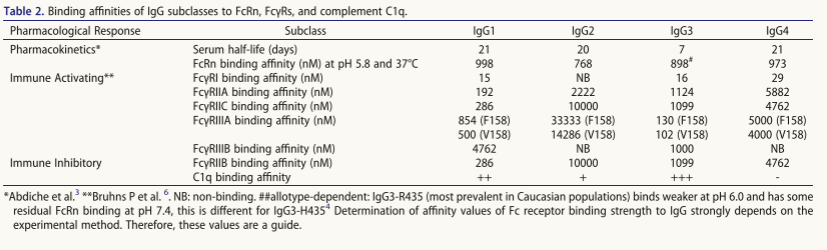
人FcγR按功能分为激活性与抑制性受体,分别通过胞内ITAM或ITIM基序传递信号,调控IgG抗体交联后的细胞功能。其中,hFcγRI(CD64)、hFcγRIIA(CD32a)、hFcγRIIC(CD32c)和hFcγRIIIA(CD16a)为活化受体,FcγRIIB(CD32b)是唯一抑制受体(表1)。除高亲和力FcγRI可结合单体IgG外,多数FcγR对IgG1Fc亲和力较低(表2),其强功能作用依赖免疫复合物介导的FcγR交联——此为下游信号传导的关键。FcγRIIIB(CD16b)因缺乏跨膜/胞质域,借GPI锚定于膜上而无直接信号能力,但需关注其中性粒细胞高表达、与FcγRIIIA同源及啮齿类/多数NHP缺失的特性,审慎评估其功能。
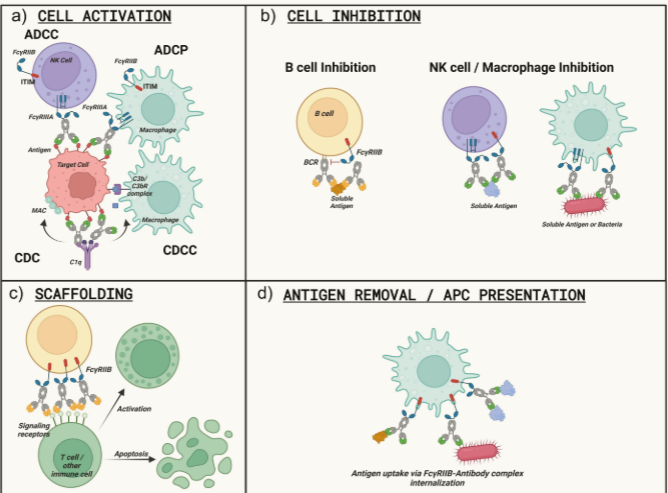
NK细胞上的FcγRIIIA介导ADCC杀伤。巨噬细胞的FcγRIIA/FcγRIIIA及中性粒细胞的FcγRIIIB可促进ADCP杀伤。FcγR(如FcγRIIB)还可通过Fab臂交联增强靶细胞激活或抑制;
FcγRIIB介导的"超级交联"可诱导靶细胞凋亡/活化。血小板/中性粒细胞上的FcγRIIA可触发介质分泌、凝血FcγRIIIB的双重性,虽通常清除循环免疫复合物而不活化中性粒细胞,但在特定条件下可与FcγRIIA协同介导IC活化。
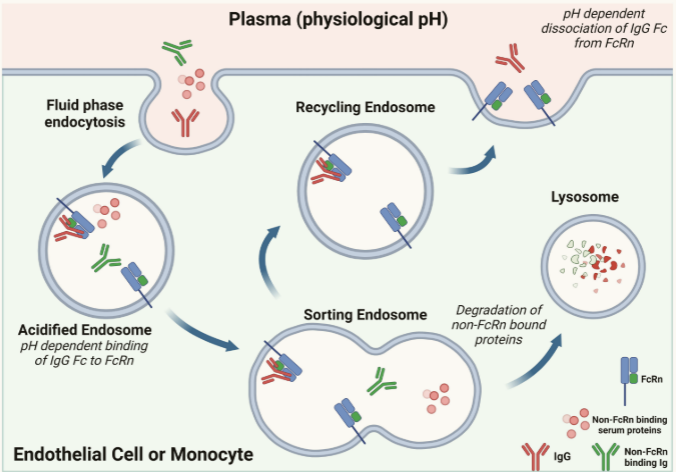
FcRn表达和功能
FcRn在免疫和非免疫组织中表达,对IgG的再循环和跨细胞转运至关重要。循环血浆蛋白(例如,抗体、白蛋白、细胞因子)可经历液相内吞作用进入内体。在进入内体、成熟和酸化后,IgG抗体(红色)可以以pH依赖性方式结合FcRn。一旦形成,FcRn-IgG复合物可以再循环至质膜,其中在循环中暴露于中性pH促进解离。与FcRn未结合或根本不能与FcRn结合的抗体和血清蛋白被靶向用于溶酶体降解,其中分解代谢酶将蛋白质分解成肽和氨基酸。
Fc效应子功能在人体中的不良作用
过度FcγR/补体激活可能引发含Fc治疗药物的安全性风险。FcγR介导的ADCC/ADCP及C1q/CDC可导致非靶向细胞杀伤、细胞因子释放(如肿瘤溶解综合征),见于OKT3/利妥昔单抗等;细胞功能紊乱:FcγR异常交联可诱发活化相关凋亡、边集、增殖抑制或内化(取决于靶点生物学);复合物炎症:循环中多价分子交联形成可溶性免疫复合物,驱动炎症反应;血栓风险:血小板FcγRIIA结合可促进活化及血栓形成(抗CD40L mAb案例);补体级联:C3a/C5a过敏毒素激活肥大细胞/嗜碱粒细胞/内皮细胞(C3aR/C5aR介导)。
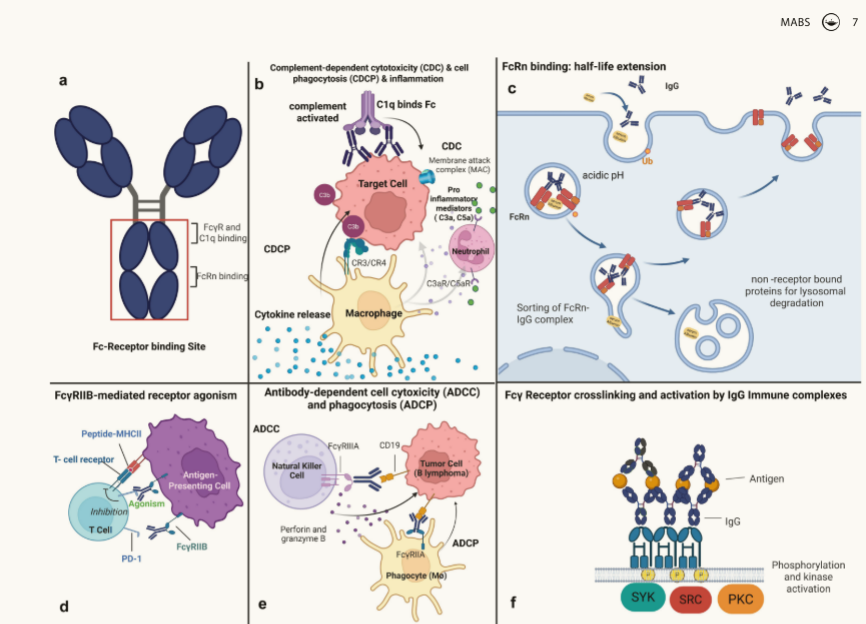
通过蛋白质和糖工程增强或消除抗体Fc功能
IgG Fc的许多效应子功能有助于治疗性mAb和相关含Fc支架的治疗功效。基于治疗目标,可通过抗体工程增强或抑制效应功能及半衰期。靶向炎性疾病时需避免Fc介导的免疫活化(如补体激活、细胞因子释放),除非需细胞耗竭(如抗癌治疗中激活NK/T细胞)。非活化IgG多采用惰性IgG2/IgG4亚型或Fc沉默改造(如IgG1/4工程化)。Fc工程化核心领域包括:(1)效应功能增强/消除; (2)半衰期调控(多为延长);(3)直接阻断FcγR/FcRn。
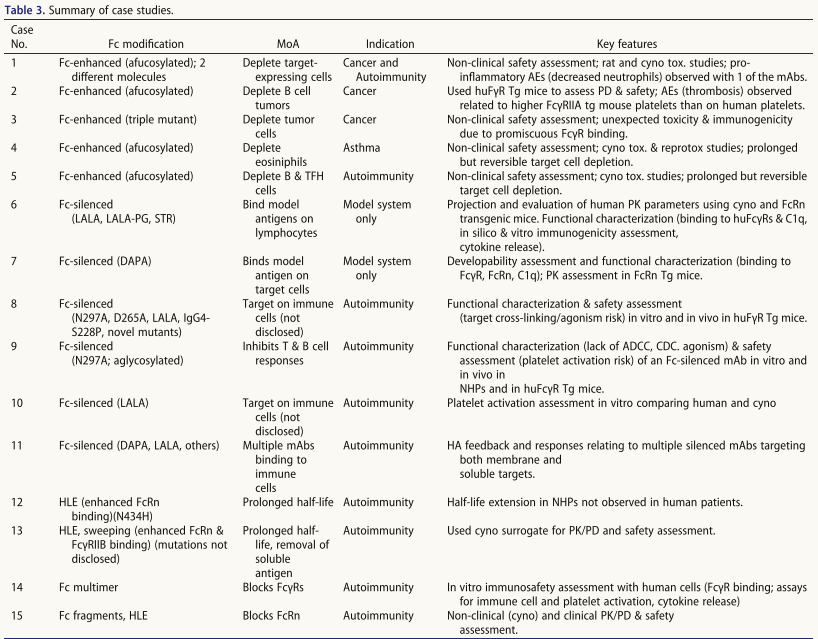
增强Fc效应子功能的氨基酸取代
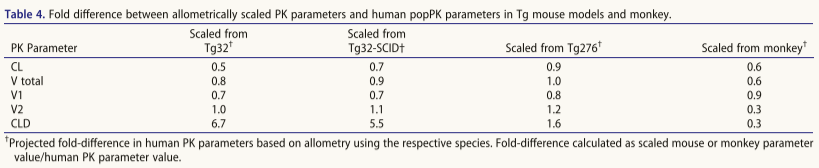
还可以在IgG Fc中进行氨基酸取代以改变激活,研究方法包括:1.丙氨酸扫描(US2006173170A1)定位结合域:a)FcγR/C1q位点:hIgG1下铰链区及近端CH2域;b)FcRn位点:"肘"区。2.计算建模与高通量筛选鉴定新型FcγR结合增强变体(表5);3.特异性突变策略:a)E345K/E430G突变促进靶向结合后六聚化,增强补体激活(CDC/ADCC);b)Q311R/M428E/N434W三联突变协同提升CDC活性及半衰期,可与去岩藻糖基化联用增强ADCC。
增强FcγRIIB结合的策略
增强FcγRIIB结合的策略最初用于抑制自身反应性B细胞,后扩展至靶向激动作用(尤其近端B细胞驱动型)。典型案例包括:1.抗DR5激动型mAb,首创需FcγRIIB交联的肿瘤杀伤;2.TNF超家族靶向mAb,靶向CD40/4-1BB/OX40(临床前验证)。表6列出相关Fc突变体,常用"SELF"及"V11"突变。多款增强FcγRIIB结合的Fc变体mAb已进入临床试验(表4)。

用于Fc沉默的糖工程改造和氨基酸取代
N297A/Q/G单点突变通过消除聚糖实现深度Fc沉默,大幅降低低亲和力FcγR/C1q结合(ADCC/CDC活性丧失),但保留FcγRI结合且热稳定性下降。多款无糖基化IgG1已进入临床。
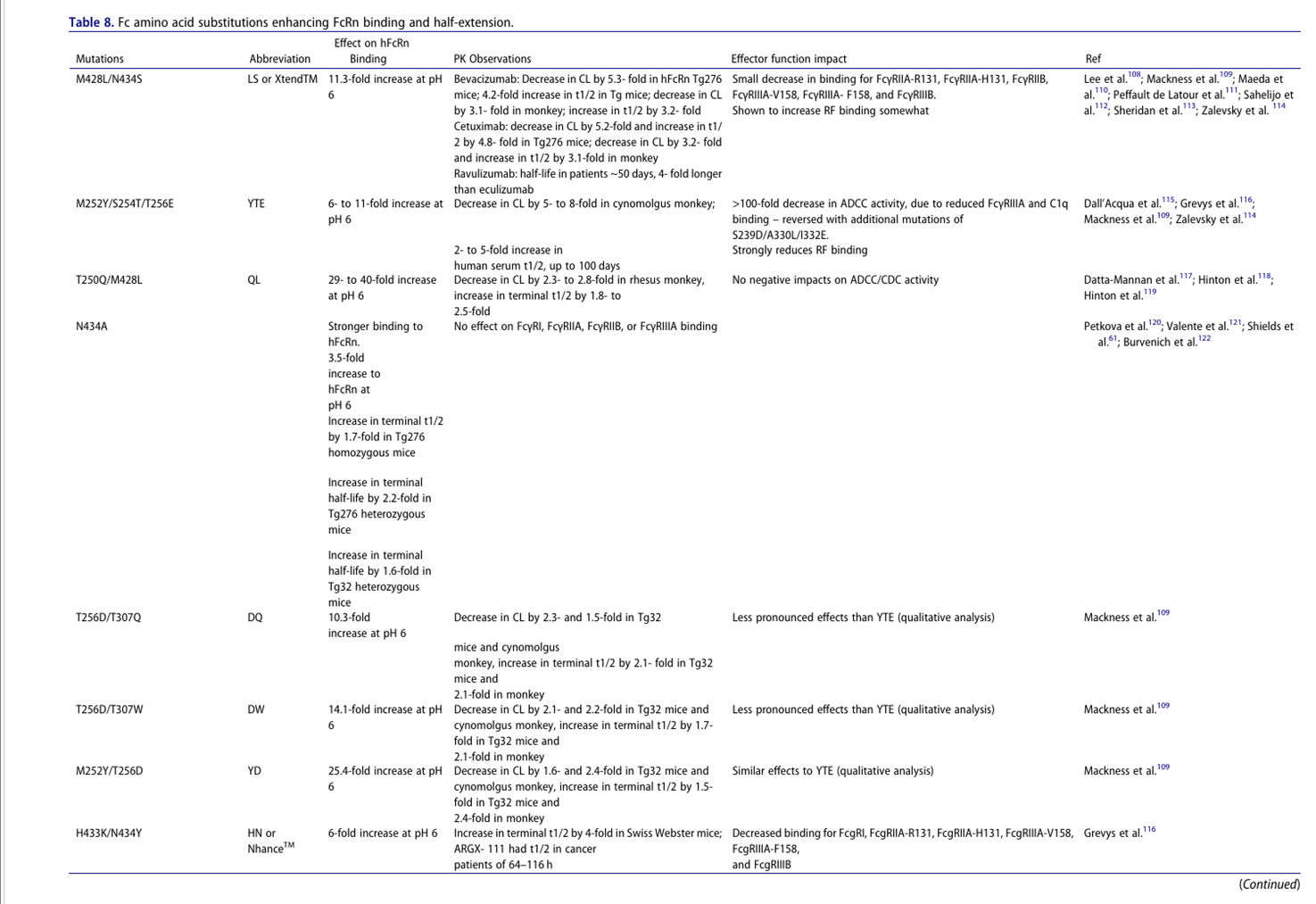
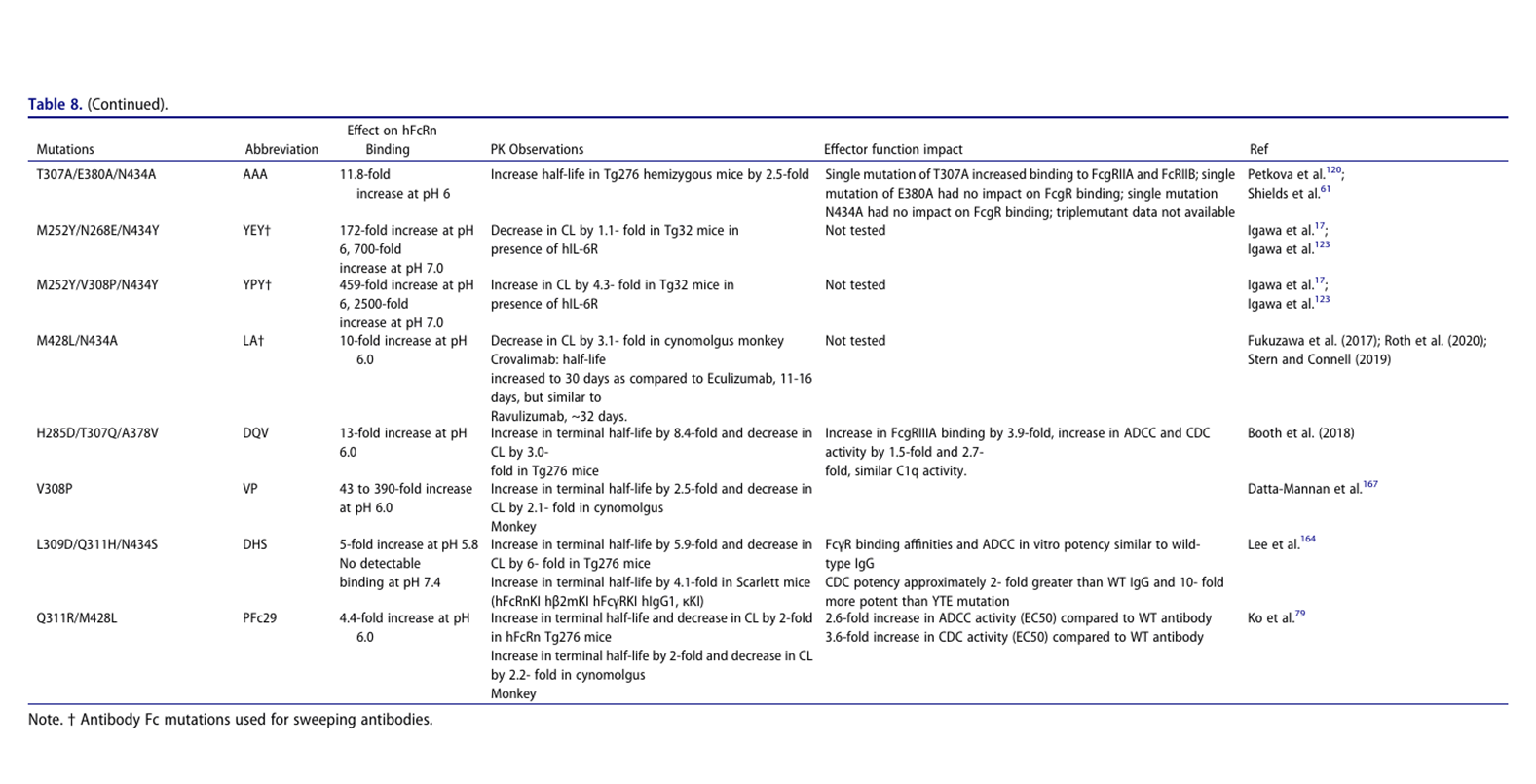
半衰期延长
半衰期延长(HLE)可提升mAb暴露量,延长药理活性、降低给药频率及成本,但需警惕其风险:1. 适用限制:a)激动剂mAb可能因长期靶向结合引发不良事件;b)对高靶点介导消除或快速转换靶点无效(病例研究12);c)可能影响FcγR及类风湿因子(RF)结合。2. 工程原理:增强pH 6下FcRn结合(非pH 7.4)。3. 清扫抗体设计:通过双机制清除可溶性靶标:a) 条件性抗原结合:中性pH结合血浆靶标(规避内体结合);b) Fc工程化:增强mAb-靶复合物内体摄取(FcγRIIB/FcRn/PI调控),实现抗原"净流入"内体降解,尤适于高浓度(如补体)或高周转率靶点(如细胞因子)。
FcγR和FcRn阻断
自身抗体疾病中,IVIG通过阻断FcγR/FcRn及补体调节起效,但存在供应限制、高成本和给药不便问题,推动重组高亲和力Fc开发:1. Fc突变体(代表性修饰)。2. Fc多聚体工程:a) Stradomers™:IgG1铰链-Fc + IgG2铰链区,广谱结合FcγR(含NHP同源物),在CIA/ITP模型有效(GL-2045 I期终止/NCT03275740);b)Fc六聚体:IgG1铰链-Fc + IgM尾段±L309C,高亲和力阻断FcγR/C1q:IgG1型:人全血中引发细胞因子/血小板/补体激活;IgG4型:无激活效应;c) Fc三聚体:结合FcγR但不激活,抑制IC功能(ITP模型有效,I期终止)。3. FcRn阻断疗法:非选择性增强IgG降解。
总结
Fc工程不仅能够且已为患者带来切实的临床益处与价值,但同时也引发了一系列复杂且相互交织的考量,若处理不当可能产生风险。随着对这些复杂性的认知不断深化,加之临床经验的持续积累与治疗应用理念的迭代发展,已推动 “LALA”“LS”“YTE” 等关键 Fc 修饰及其衍生物得到广泛应用。