蛋白-蛋白相互作用是细胞结构和功能的基础,大多数蛋白质在行使功能时不是单独发挥作用的,而是通过与其他蛋白质相互作用后发挥生物学功能。该作用介导了催化、转运、信号传导等生物学过程,它在理解蛋白的功能,疾病发病机制,药物研发中发挥重要作用。目前常用的蛋白蛋白互作方法有:表面等离子共振(SPR)、免疫共沉淀(Co-IP)、GST pull-down、免疫荧光(IF)、共定位酵母双杂交系统(Y2H)、荧光共振能量转移(FRET)、邻近标记技术(PL)、双分子荧光互补(BiFC)、等温滴定量热分析(ITC)和双电子-电子共振光谱(DEER)。本文将对这些方法进行简单的概述,比较。
表面等离子共振(SPR)
SPR(表面等离子共振)技术是一种用于研究蛋白-蛋白相互作用的分析技术。其基本原理是利用光在棱镜与金属膜表面上发生全反射现象。当一束特定角度的光照射到金属薄膜(例如金膜)上时,金属中的自由电子会与光波相互作用,形成一种称为表面等离子体共振(SPR)的现象。这种共振会导致在特定角度(即SPR角)处反射光的强度显著下降。由于SPR状态对金属表面附近的介质折射率变化极为敏感,当生物分子与金属表面结合时,会引起局部折射率的变化,进而导致SPR角发生偏移。通过精确测量这种角度的变化,我们可以实时监测生物分子间的相互作用,包括结合和解离的过程。
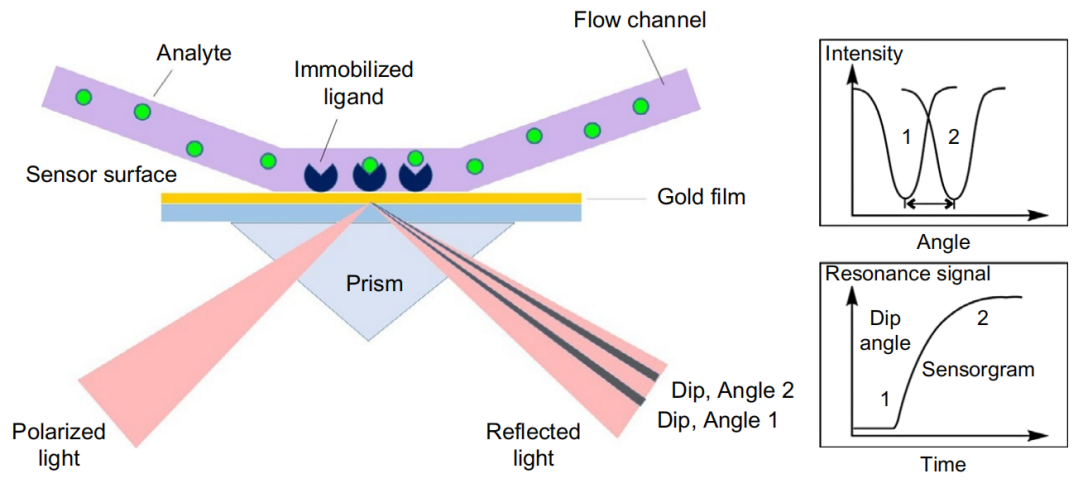
(数据来源 Drescher DG, et al. Adv Protein Chem Struct Biol. 2018)
免疫共沉淀(CO-IP)
免疫共沉淀(Co-IP)广泛用于蛋白质-蛋白质相互作用(PPI)的识别和验证。它是基于诱饵蛋白与其抗体之间的特异性免疫学相互作用,共沉淀已成为检测蛋白质间生理相互作用的可靠有效方法。
在非变性条件下裂解细胞时,许多细胞内蛋白质-蛋白质相互作用得以保留。例如,诱饵蛋白(如蛋白质X)可以通过其特异性抗体稳定到琼脂糖珠上而被捕获。如果存在另一种蛋白质,猎物蛋白(如蛋白质Y),它与蛋白质X在体内结合,那么通过抗体可以将蛋白质X-蛋白质Y复合物一起沉淀下来。随后,通过对蛋白质Y的调查,我们可以确认蛋白质X-蛋白质Y之间的相互作用,或者发现蛋白质X的新互作蛋白。
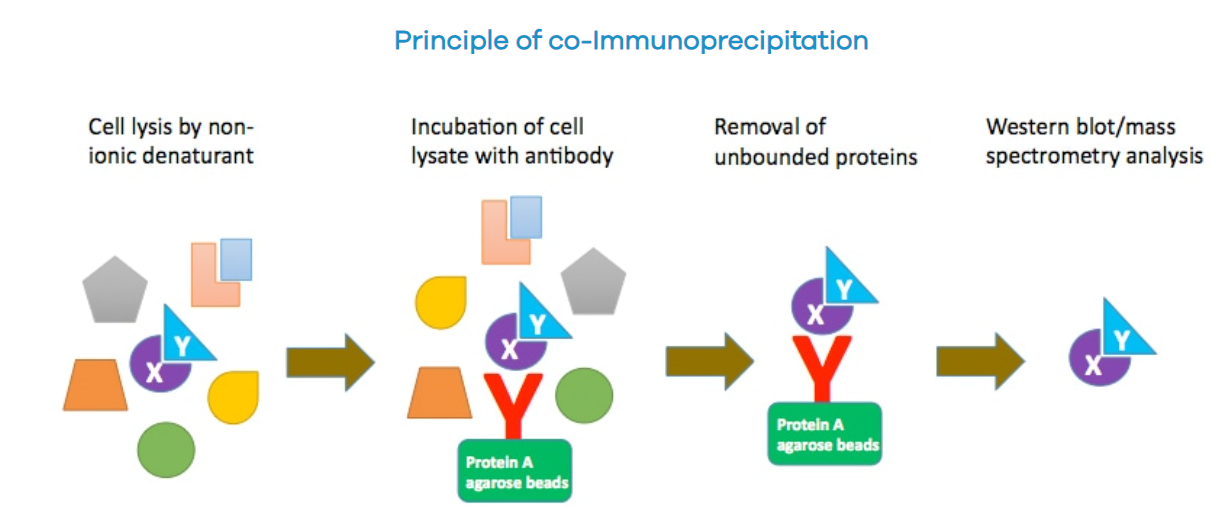
(数据来源 profacgen官网)
GST-pull down
GST-pull down实验是一种体外亲和纯化方法,利用诱饵蛋白富集与诱饵蛋白相互作用的蛋白质。
它利用融合蛋白标签(如GST标签、His标签和生物素标签)固定在亲和树脂上作为诱饵蛋白。当目标蛋白或细胞裂解液流过时,与诱饵蛋白结合的蛋白质(猎物蛋白)可以被捕获并“拉下来”。通过后续洗脱和分析使用Western blot或质谱(MS),发现的现有蛋白-蛋白相互作用,或初步筛选以识别新的蛋白-蛋白相互作用。
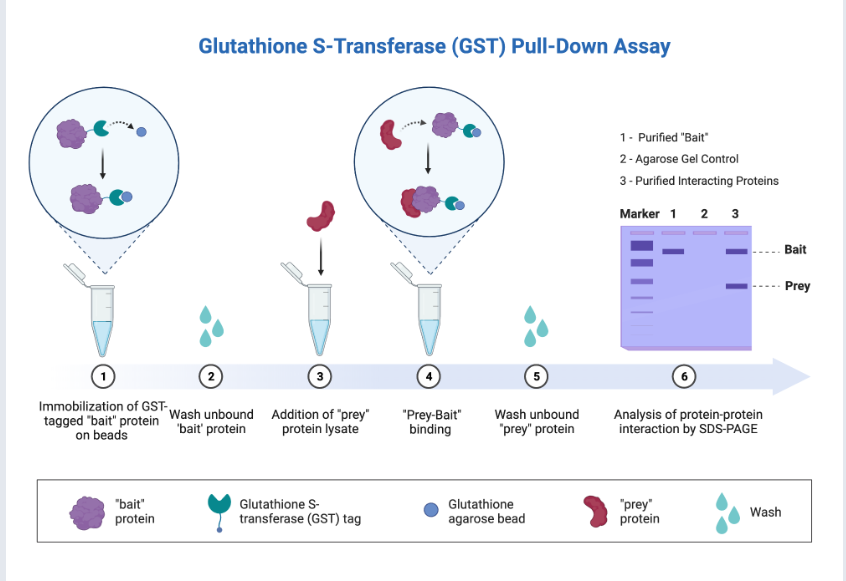
(数据来源 BioRender)
免疫荧光(IF)共定位
免疫荧光(IF)共定位是免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。一般用来验证2种或3种蛋白是否存在共定位关系。由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位。两种不同的蛋白使用不同属性的不同颜色荧光标记后,通过观察颜色的变化确定是否有共定位,也可以使用软件进行分析。

(数据来源 Ruiz-Gómez G, et al. Hempel U. Sci Rep. 2019)
酵母双杂交系统(Y2H)
酵母双杂交系统利用真核生物转录激活因子的两个独立结构域,即DNA结合域(BD)和转录激活域(AD),只有这两个结构域共同作用时才能使转录正常进行。在酵母双杂交系统中,将“诱饵”蛋白和“猎物”蛋白分别与AD和BD融合,形成两个融合蛋白。如果这两种蛋白质在酵母细胞中相互作用,它们将使得AD和BD在空间上足够接近,从而重建一个有功能的转录激活因子,激活报告基因的表达。
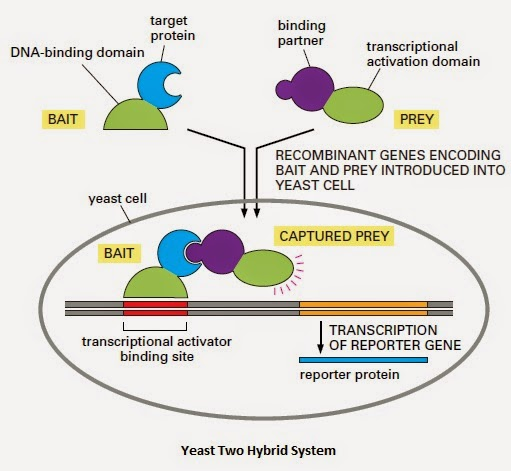
(数据来源 所用图片来自网络,如侵权,请联系删除)
荧光共振能量转移(FRET)
荧光共振能量转移(FRET)是一项早期开发的技术。随着绿色荧光蛋白(GFP)应用技术的发展,FRET已成为检测生物大分子纳米尺度距离变化的有力工具,在体内免疫分析具有广泛的应用。FRET是两个彼此非常接近的荧光分子之间的能量转移现象,这两种荧光基团分别称为能量供体Donor和能量受体Acceptor。当供体分子的发射光谱与受体分子的吸收光谱重叠,并且两个分子之间的距离在10nm以内时,就会发生非放射性能量转移,即FRET。它将能量共振转移到受体上,这使得供体的荧光强度远低于单独存在时(荧光猝灭),而受体发出的荧光大大增强(敏化荧光)。FRET技术可以在活细胞内进行,无需标记,具有很高的灵敏度和特异性。
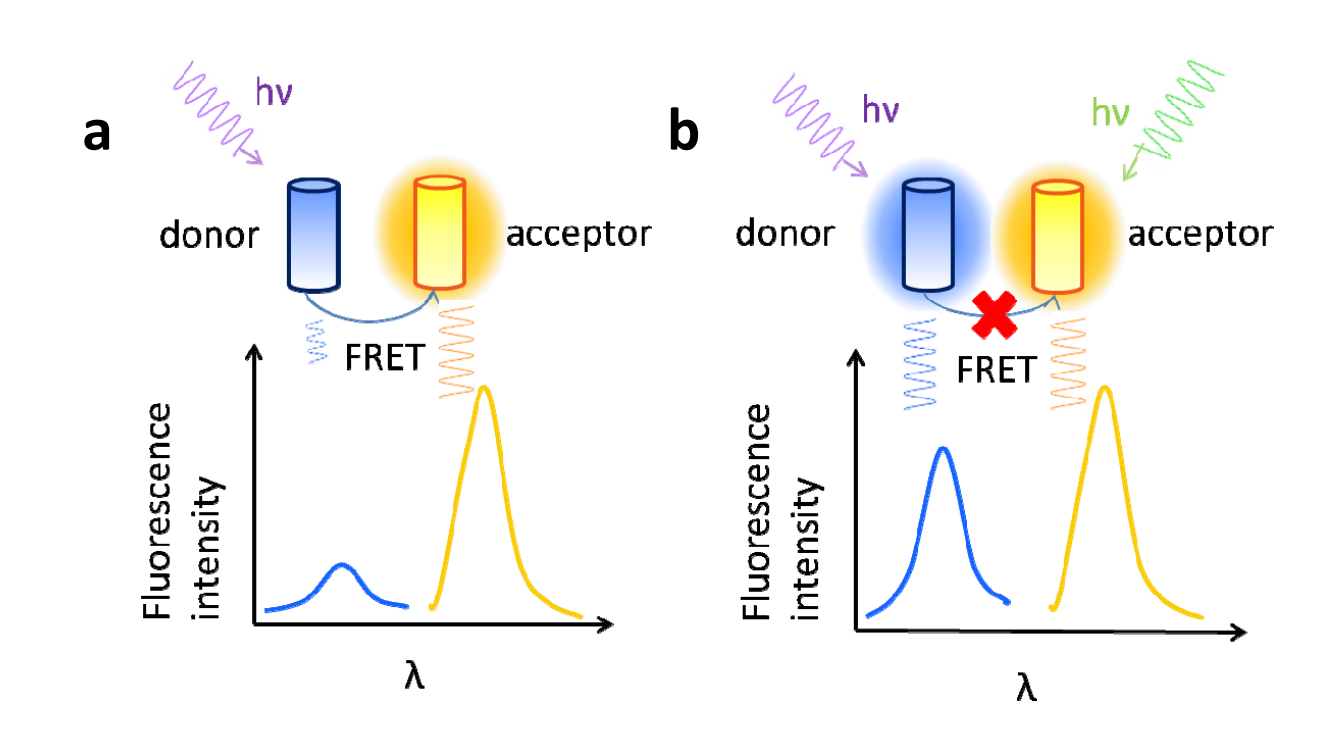
(数据来源 Xu F, et al. Opt Express. 2013)
双分子荧光互补(BiFC)
双分子荧光互补(BiFC)分析能够直接观察活细胞中的蛋白质相互作用。BiFC基于荧光蛋白的分裂和重组,荧光蛋白通常分为N端片段和C端片段。当两个靶蛋白相互作用时,荧光蛋白的N端和C端片段将相互接近并重新组合以恢复原始结构和特性,从而产生荧光信号来反映靶蛋白的相互作用,为检查细胞信号通路提供实质性帮助。BiFC通过能够检查信号转导蛋白与其下游效应蛋白之间的相互作用以及分析细胞内的信号传递,为细胞信号通路的研究做出了重大贡献。
除此之外,基于BiFC技术,还衍生了许多其他的荧光互补技术,例如 mcBiFC,TriFC,dcas13a-SunTag-BiFC,BiFC-TALE。
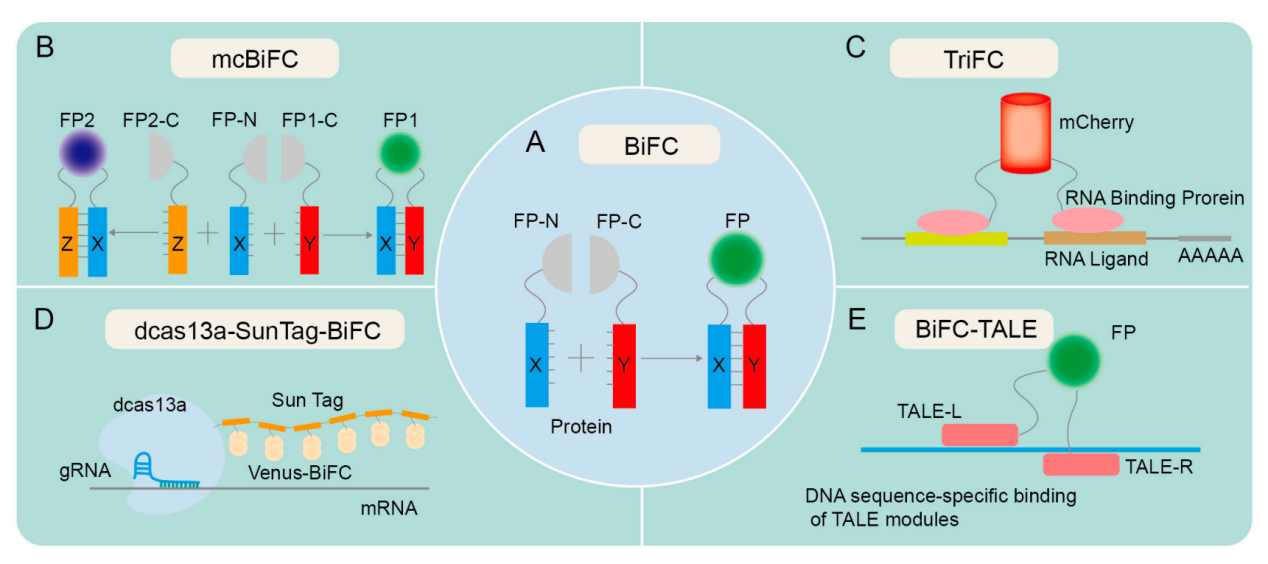
(数据来源Ren H, et al. Biomolecules. 2024)
等温滴定量热分析(ITC)
等温滴定量热法(ITC)是一种用于各种分子相互作用定量研究的技术。这种方法已被广泛应用于研究大分子(通常是蛋白质)与小配体的相互作用,其他蛋白质,核酸,药物。它的工作原理是直接测量分子结合事件期间释放或吸收的热量。在ITC实验中,将一种反应物放置在温控样品池中,通过热流回路连接到参比样品池,两个样品池处于相同的外部环境中。将特定的滴定剂(例如天然活性化合物)逐渐注入样品池中。样品和滴定剂发生反应时,热量被吸收或释放。每次进样后,热量被吸收或释放,导致样品和参比池之间的温度发生变化。利用与等温滴定量热仪集成的软件,可以通过数据拟合获得结合常数、化学计量(n)和焓变等参数,从而获得对分子相互作用的全面热力学见解。

(数据来源 Jiang X, et al. Heliyon. 2024)
双电子-电子共振光谱(DEER)
双电子-电子共振光谱(DEER)它用于研究细胞裂解物或细胞内的蛋白质结构和相互作用相关,可用于测量分子内部和分子之间的距离。通过双电子-电子共振(DEER,也称为PELDOR)技术进行距离测量允许通过测量两个电子自旋之间的偶极相互作用来获得距离约束。EEER利用自旋标记技术,通过观察自由基之间的相互作用,精确测量分子间的距离,并且可以应用于复杂的生物环境中。通过分析不同延迟时间下的信号变化,可以推断出自旋标记之间的距离。
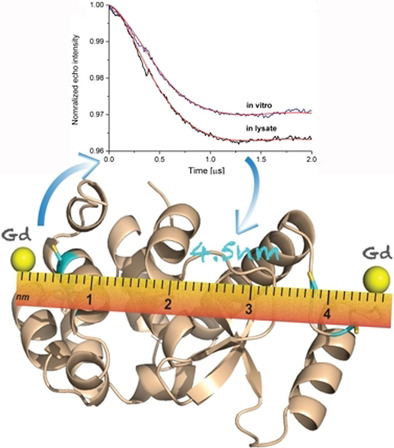
(数据来源 Miao Q, et al. Chemistry. 2020)
邻近标记技术(PL)
邻近标记技术(PL)使用工程化酶,例如过氧化物酶或生物素连接酶,它们在基因上标记到目标蛋白(POI)。PL 酶将惰性小分子底物转化为短寿命反应性物质,它们从酶活性位点扩散出去,共价标记邻近的内源性物质。底物分子通常包含一个生物素手柄,以便随后使用链霉亲和素珠富集标记物种,并通过质谱法(蛋白质)或核酸测序(RNA)鉴定它们。
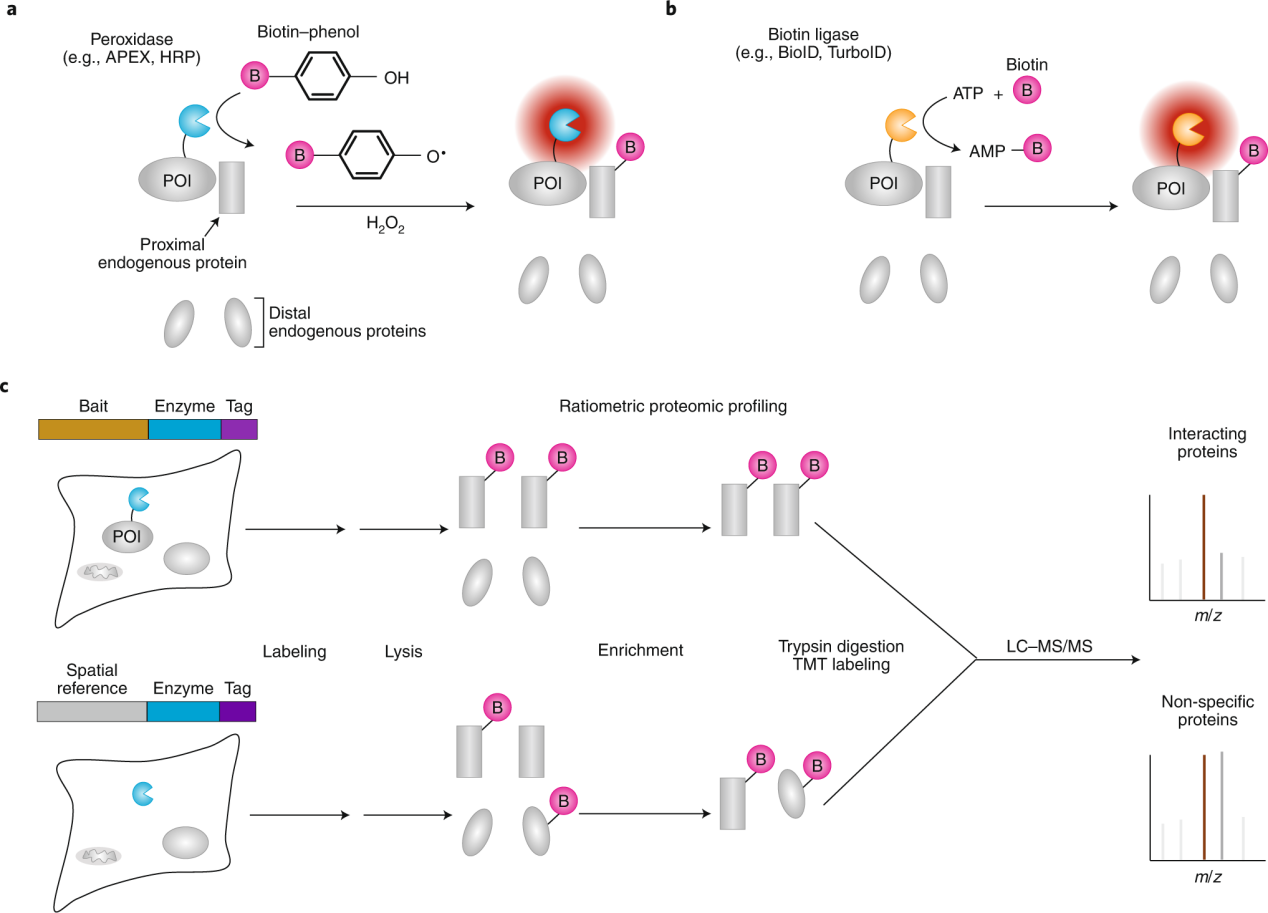
(数据来源 Qin W, et al. Nat Methods. 2021)
蛋白-蛋白互做技术的比较
这些蛋白-蛋白互作技术都有其独特的优势和局限性,选择合适的方法时,考虑实验的目的。同时通过结合使用多种技术可能会提供更全面的研究结果。

