服务支持
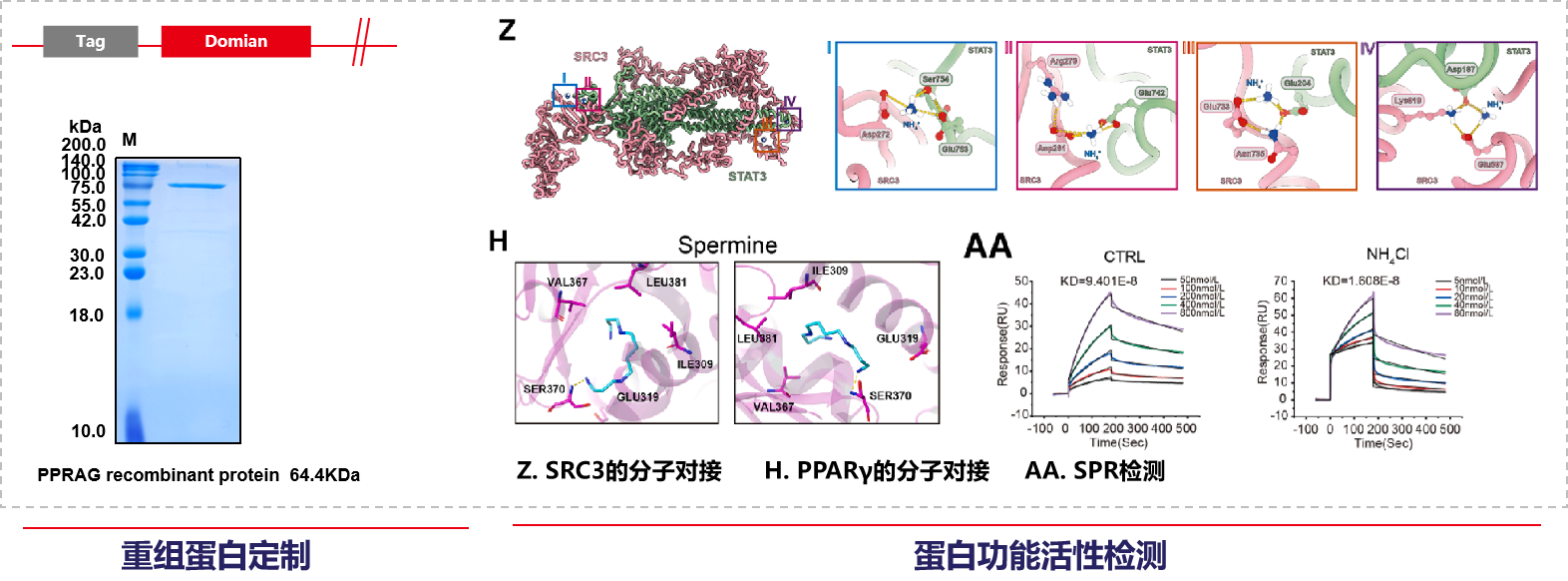
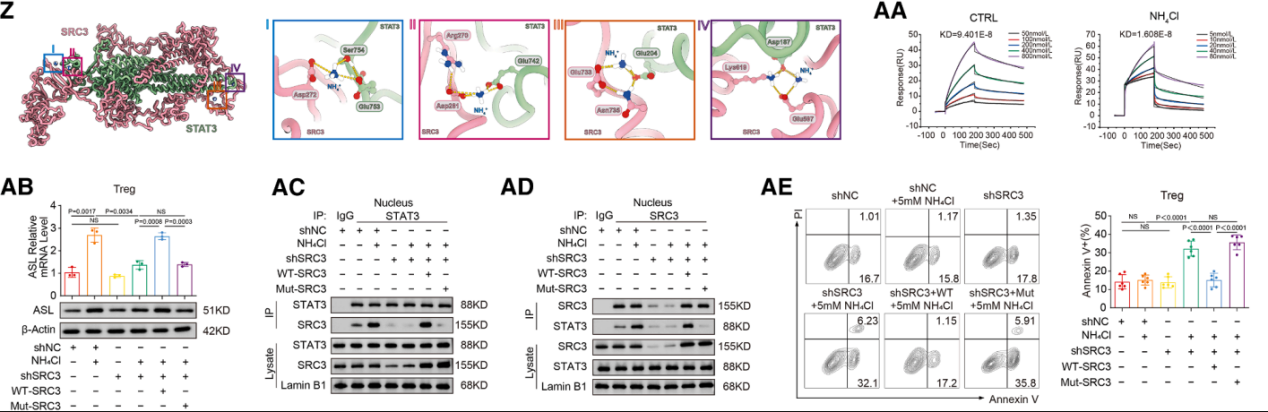
迈思生物承担了该研究中重组蛋白表达,分子对接动力学模拟,SPR亲和力检测等服务。
背景
调节T细胞(Tregs)具有forkhead盒蛋白P3(FOXP3)的表达特征,是抑制抗肿瘤免疫反应的关键因素。随着肿瘤的发展,Tregs会在肿瘤微环境(TME)中逐渐积累,而效应T细胞的数量则会相应减少。Tregs适应严酷的肿瘤代谢微环境从而抑制抗肿瘤免疫的机制仍不清楚。

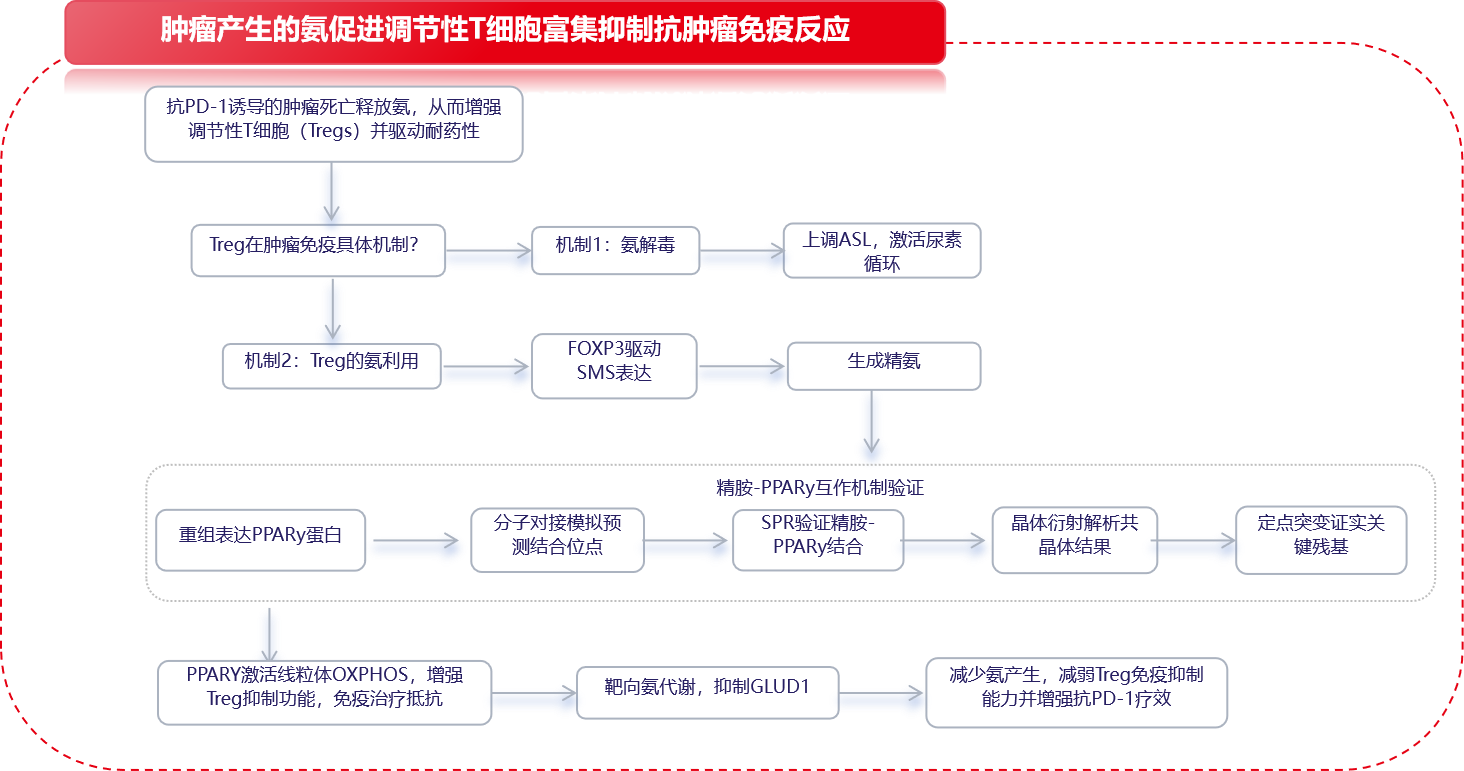
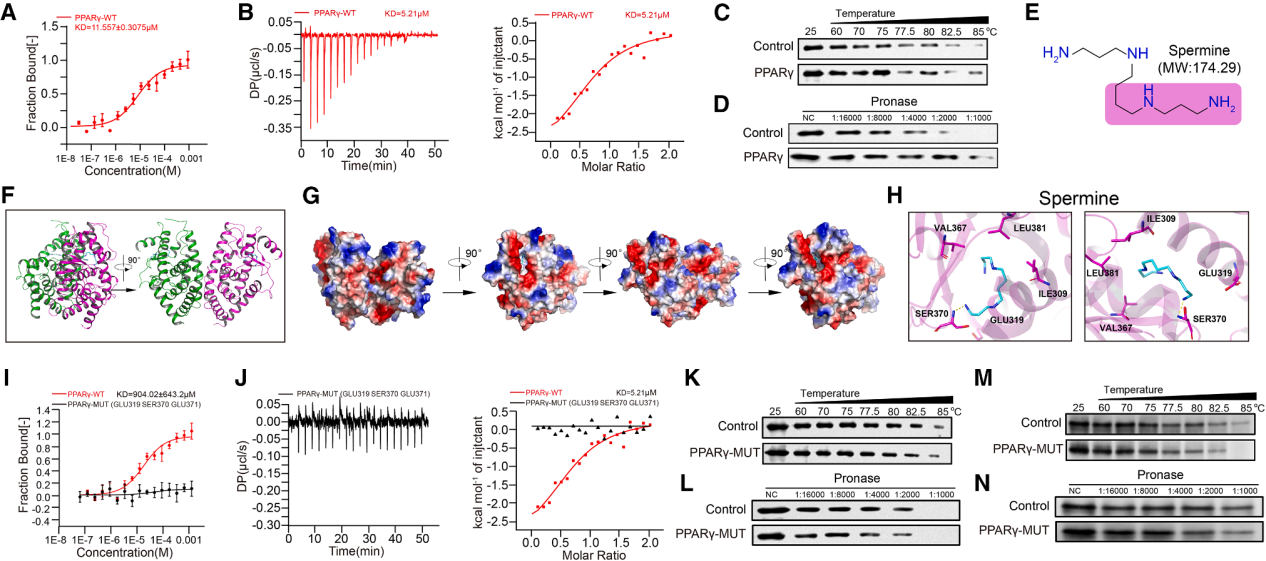
2025年12月24日徐州医科大学附属医院吕凌团队在Cell上发表了一篇名为“Tumor-produced ammonia is metabolized by regulatory T cells to further impede anti-tumor immunity”的研究成果。在该研究中,利用空间代谢组学和转录组学,发现人肝细胞癌具有以高谷氨酰胺分解和氨含量为特征的代谢异质性亚区,在这些亚区中,Treg细胞经常出现,但CD8+和CD4+效应T细胞死亡。Tregs通过上调精氨酰琥珀酸裂解酶(ASL)来利用尿素循环解毒氨;同时,氨也通过FOXP3转录因子调节的精胺合成酶(SMS)转化为精胺。X射线晶体学验证了精胺和PPARγ之间的直接相互作用,从而全面调节多种线粒体复合物蛋白的转录,从而增强Tregs的氧化磷酸化和免疫抑制。临床上,抗PD -1治疗的死亡肿瘤细胞通过转脱氨释放氨,增强Treg功能,导致免疫治疗抵抗。以产氨为靶点抑制Treg细胞为抗肿瘤免疫治疗提供了潜在策略。
研究摘要
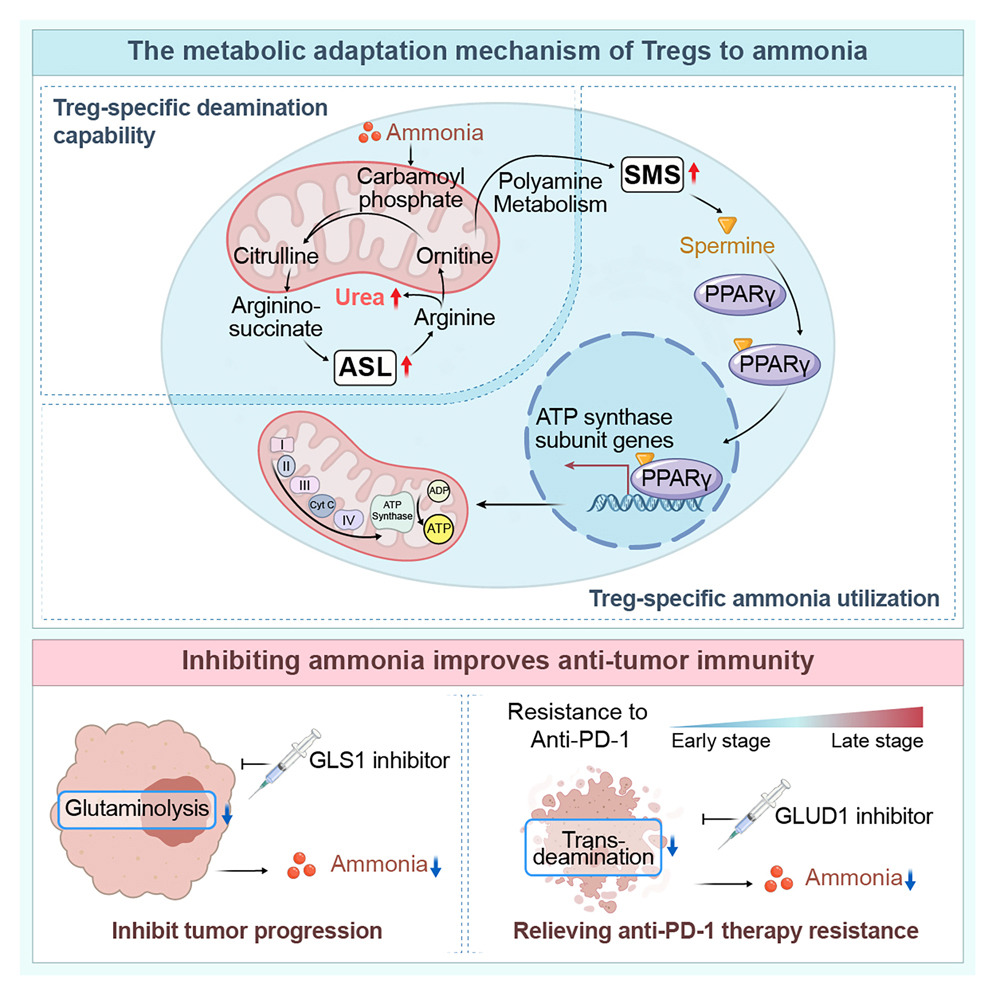
调节性T细胞(Treg)存在两种特异性氨适应机制:SRC3/STAT3-ASL驱动的尿素循环通路,以及SMS-精胺- PPARγ轴。
尿素循环:氨增强Treg活性,同时抑制其他T细胞群,从而在肿瘤区域强化免疫调节效应。Treg上调ASL,以氨依赖性方式促进氨解毒,这反映了其独特的氨感知能力。

多胺代谢:尿素循环中间产物鸟氨酸被引导至多胺通路,其中FOXP3转录的酶SMS将其转化为精胺,后者结合并激活PPARγ,驱动呼吸链和OXPHOS上调,从而进一步增强Treg功能。肿瘤来源的多胺促进Treg介导的免疫逃逸,而SAT1驱动的多胺释放则使Treg失稳。内源性产生的精胺直接维持Treg的稳定性和功能。
抗PD-1诱导的肿瘤死亡释放氨,从而增强调节性T细胞(Tregs)并驱动耐药性。肿瘤通过谷氨酰胺分解作用产生氨,抑制GLS1可降低氨水平并增强抗PD-1疗效。与单独抑制GLS1相比,将GLUD1抑制剂与抗PD-1疗法联合使用能更有效地减少氨蓄积及调节性T细胞(Treg)介导的耐药性。靶向调控氨生成可能成为突破肿瘤免疫治疗耐药性的有效策略。

结论
本研究揭示,肿瘤来源的氨驱动Tregs特异性富集。Tregs通过激活尿素循环及促进精胺合成两条代谢途径,实现对氨的解毒与利用,进而增强其免疫抑制功能。接受抗PD-1治疗的濒死肿瘤细胞通过转脱氨作用释放氨,这强化了Treg的免疫抑制功能,导致免疫治疗耐药。抑制氨的产生以抑制 Tregs 是抗肿瘤免疫治疗的一个潜在策略。