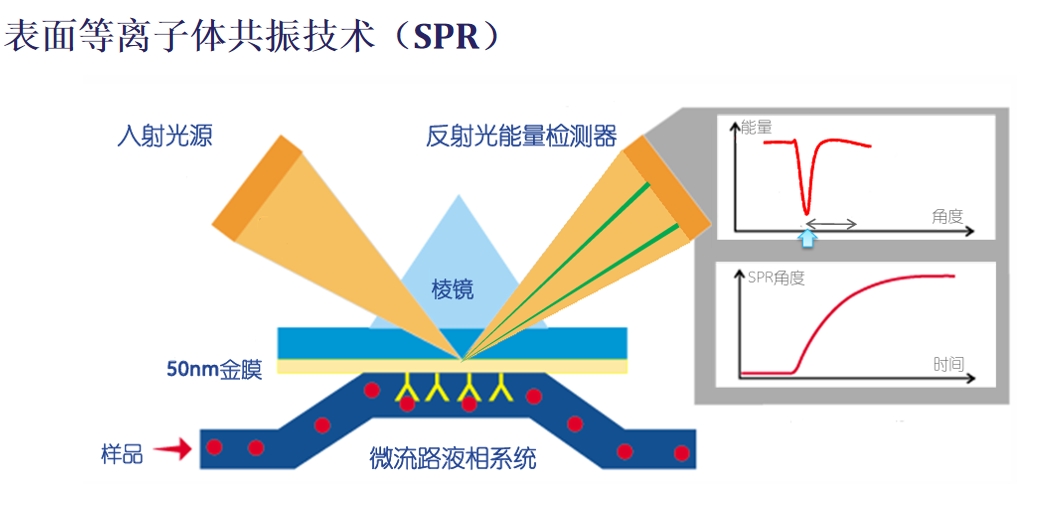

(数据来源:思拓凡官网)
背景
表面等离子体共振(SPR)是一种成熟的无标记技术,可直接测量生物分子亲和力。SPR分析需要将一种相互作用的成分(配体)固定在导电金属(主要是金或银)上,并在表面上连续流动含有潜在结合伙伴(分析物)的溶液。当偏振光激发金属和介电介质界面处的电子以产生与表面平行传播的电磁波时,就会发生SPR现象。通过检测反射光来测量由于配体和分析物之间的相互作用而导致的折射率变化,从而提供有关动力学和特异性的实时数据。
原理:SPR技术的核心原理是一种物理光学现象,用于实时、无标记地检测生物分子间的相互作用。物理现象:当一束偏振光在特定角度(入射角)照射到金属薄膜(通常是金膜)与介质(如缓冲液)的界面时,光会发生全内反射,并产生一种消逝波(Evanescent Wave)穿透金属薄膜。等离子体共振:消逝波与金属薄膜中的自由电子相互作用,可以激发产生一种沿着金属表面传播的电子密度波,称为表面等离子体波(Surface Plasmon Wave, SPW)。共振条件:当消逝波的波矢量与表面等离子体波的波矢量匹配时,会发生能量转移,导致反射光强度急剧下降,形成一个共振谷(SPR dip)。此时对应的入射角称为SPR角。检测:SPR角对金属表面介质的折射率极其敏感。任何在金属表面发生的结合事件(如蛋白质与配体的结合)都会导致表面物质质量或浓度的变化,从而引起折射率的微小改变。这种改变会立即导致SPR角发生移动。通过实时追踪SPR角的变化(响应信号,Response Unit, RU),就可以实时、动态地监测分子结合和解离的整个过程,而无需对样品进行任何标记(如荧光、放射性标记)。
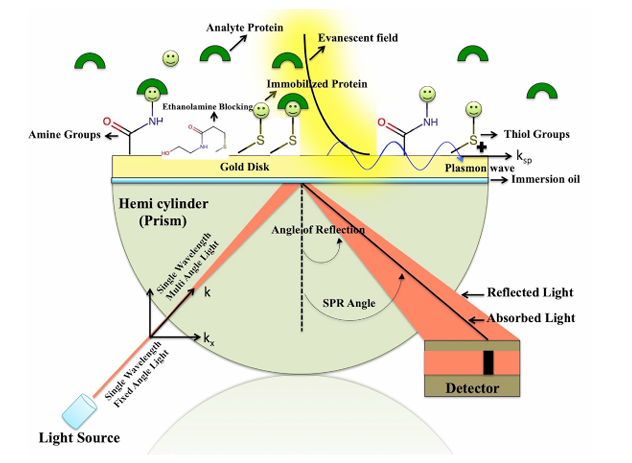
(数据来源:Rath PP , et al. Bio Protoc. 2020)
实验步骤/流程
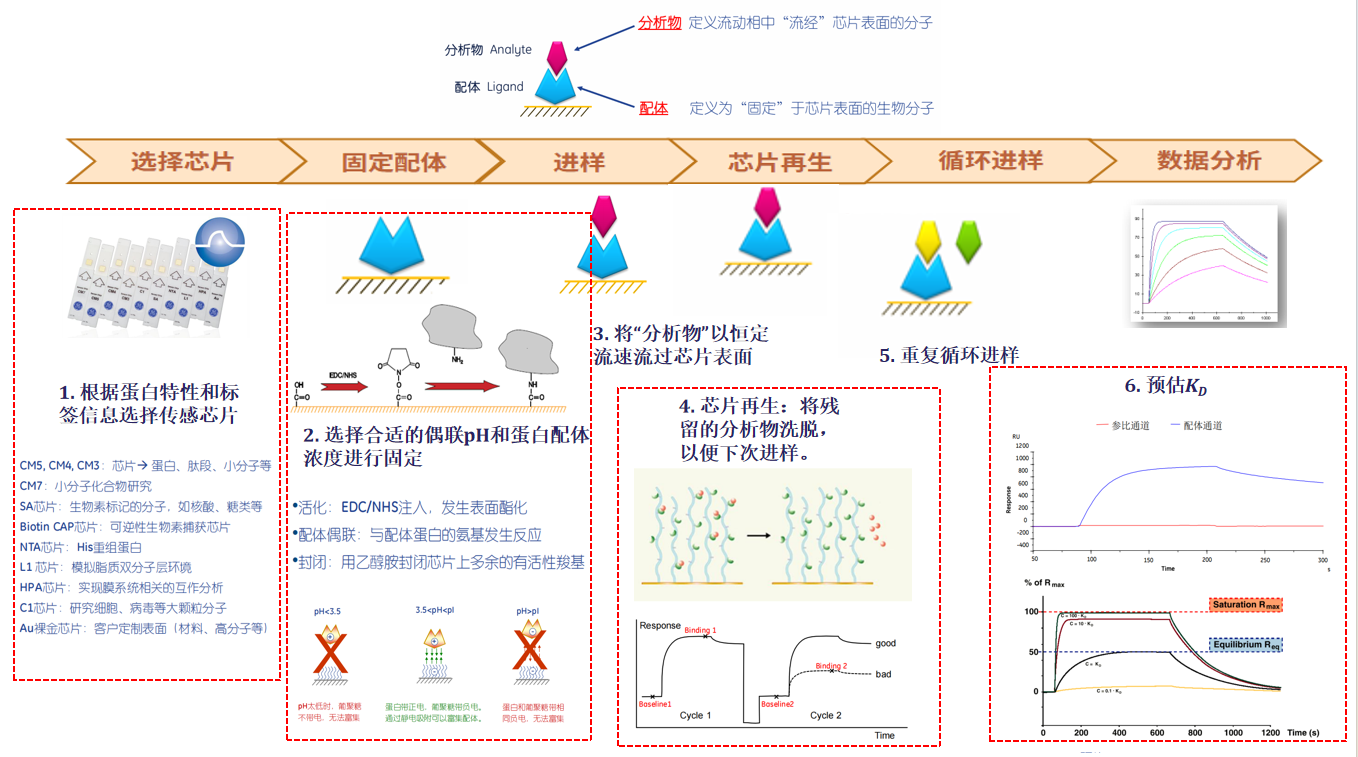
1) 传感器芯片预处理:选择合适的芯片(如羧基葡聚糖芯片CM5),使用EDC/NHS等试剂活化芯片表面的羧基,使其变为活泼酯。
2) 配体固定化(Ligand Immobilization):将已知的生物分子(蛋白质、DNA等,称为“配体”)通过共价偶联(如胺偶联、巯基偶联)等方式固定在芯片表面。一个流道固定配体,另一个流道作为参比,用于扣除非特异性信号。
3) 基线平衡:将孵育后样品上样到仪器,启动SPR分析,检测分子间相互作用的热力学、动力学参数。
4) 样品结合测试(Binding Assay):将待测的样品分子(称为“分析物”)以恒定流速流过芯片表面。a)结合阶段(Association):分析物与配体结合,导致芯片表面质量增加,SPR信号(响应单位RU)上升;b)解离阶段(Dissociation):切换回运行缓冲液,分析物从配体上解离下来,SPR信号下降。
5) 再生(Regeneration):使用温和的酸、碱或高盐溶液洗脱掉仍紧密结合的分析物,使芯片表面恢复至初始状态,以便进行下一次进样。
6) 数据分析:实时监测整个过程的SPR信号变化(传感器图),通过软件分析获得结合动力学常数(结合速率常数ka、解离速率常数kd)和亲和力常数(KD)。
SPR特点:
1) 实时监测/无标记(Real-time&Label-free):无需对样品进行荧光或放射性标记,即可实时观察分子相互作用的动态全过程。
2) 高灵敏度:能检测到非常微小的质量变化(皮克级)。
3) 提供丰富的动力学信息:不仅能得到结合强弱(亲和力,KD),还能揭示结合的快慢(动力学,ka,kd)。
4) 样品消耗少:所需样品量很少(通常μL级)。
5) 自动化高通量:现代SPR仪器可实现自动化操作和较高通量的筛选。
6) 仪器昂贵:设备和耗材(如芯片)成本较高。
7) 对缓冲液匹配要求高:分析物溶液与运行缓冲液的成分必须高度一致,否则会因折射率差异产生巨大假信号。
SPR的应用:
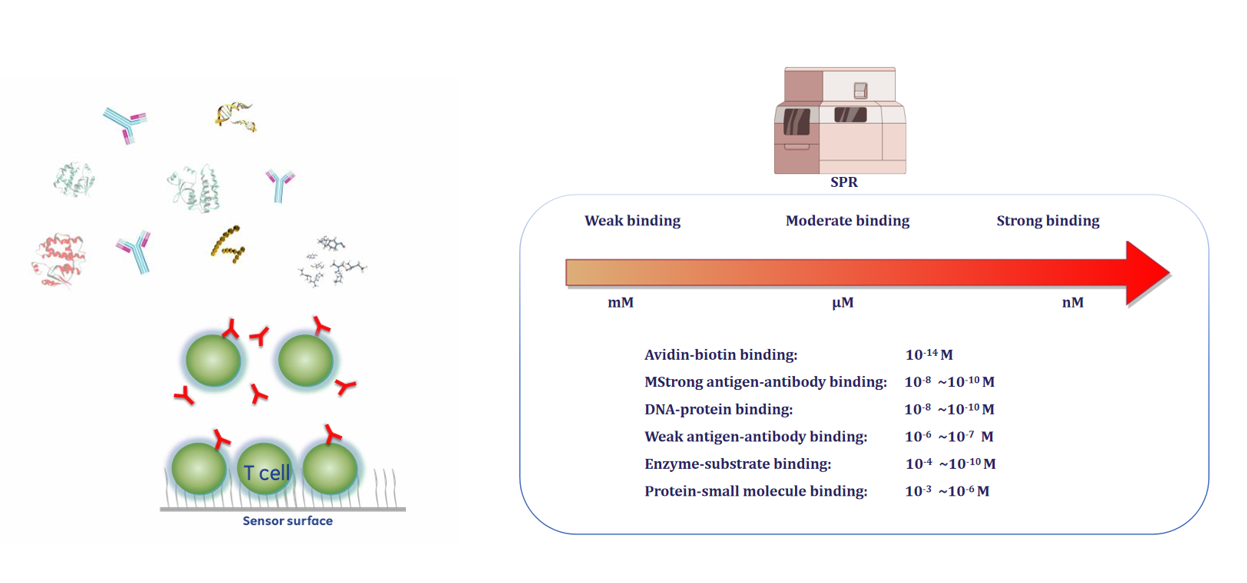
1) 生物分子互作研究:蛋白质-蛋白质、蛋白质-肽段、蛋白质-核酸、蛋白质-小分子、抗体-抗原等相互作用的鉴定和定量分析。
2) 药物筛选与开发:a)先导化合物筛选:快速筛选与靶点蛋白结合的小分子药物;b)抗体药物表征:精确测定抗体对靶抗原的亲和力和动力学。
3) 表位作图(Epitope Mapping):判断不同抗体是否结合在同一抗原位点。
4) 临床诊断与生物传感:作为高灵敏度的生物传感器,用于检测疾病标志物、病毒、病原体等。
5) 食品安全与环境监测:检测食物中的过敏原、毒素、农药残留等。
案例:
蛋白-蛋白相互作用:
a)PD-1&PD-L1:
Tess Puopolo等人开发了一种基于表面等离子共振(SPR)技术的新型PD-1/PD-L1阻断测定方法。该方法将人PD-1固定于传感器芯片,使其与PD-L1蛋白、小分子抑制剂或阴性对照物发生相互作用,进而测定结合动力学与阻断率。本方案适用于筛选能阻断PD-1/PD-L1相互作用的化合物,并成功验证了已知抑制剂BMS-1166、BMS-202及阴性对照NO-Losartan A的阻断效果,通过计算阻断率获得IC50值。该方法可广泛应用于癌症免疫治疗中小分子PD-1/PD-L1抑制剂的发现。

(数据来源:Tess Puopolo , et al. Bio Protoc. 2023)
b)溶组织内阿米巴EhP3&肌动蛋白调节蛋白Coactosin:
Rath PP等人使用SPR阐明了EhP3与原生生物病原体溶组织内阿米巴中肌动蛋白细胞骨架之间的联系。并成功筛选到能与EhP3结合的几种肌动蛋白结合/肌动蛋白调节蛋白(Coactosin、Actophorin、Twinfilin、Profilin和Filamin)。最终结果表明Coactosin是EhP3的重要相互作用伙伴。完整的动力学分析确实证实EhCoactosin与EhP3的亲和常数为3 μM。
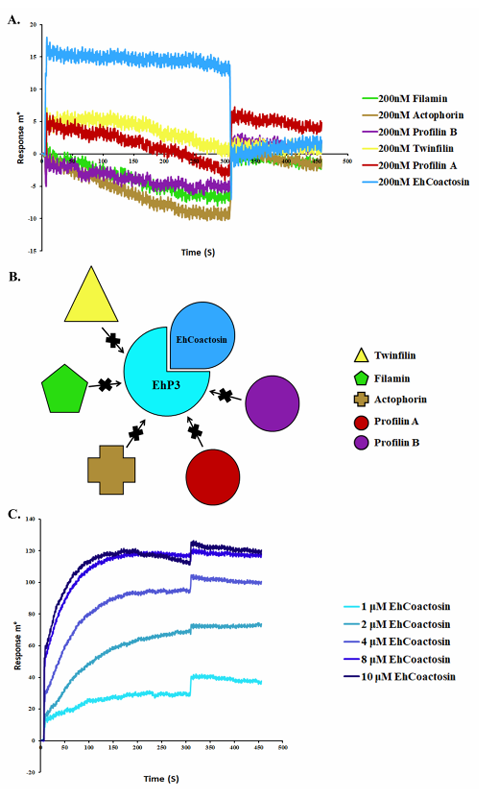
(数据来源:Rath PP , et al. Bio Protoc. 2020)
c)埃博拉病毒糖蛋白GPcl&人类胆固醇转运体NPC1-C:
2016年中科院微生物所高福院士团队解析了EBOV的GPcl与NPC1-C结构域结合的2.3Å分辨率晶体结构,发现NPC1-C通过两个突出环结合GPcl头部疏水腔,酶切及NPC1结合引发GPcl构象变化,激活内部融合环触发膜融合,揭示丝状病毒晚期内体入侵的结构机制;同时,病毒先经C型凝集素(如DC - SIGN、L-SIGN)等附着因子结合细胞表面(非真正入侵受体),再经巨胞饮样过程内化、早期及晚期内体转运。该研究为设计阻断病毒入侵的治疗性抑制剂奠定分子与结构基础。
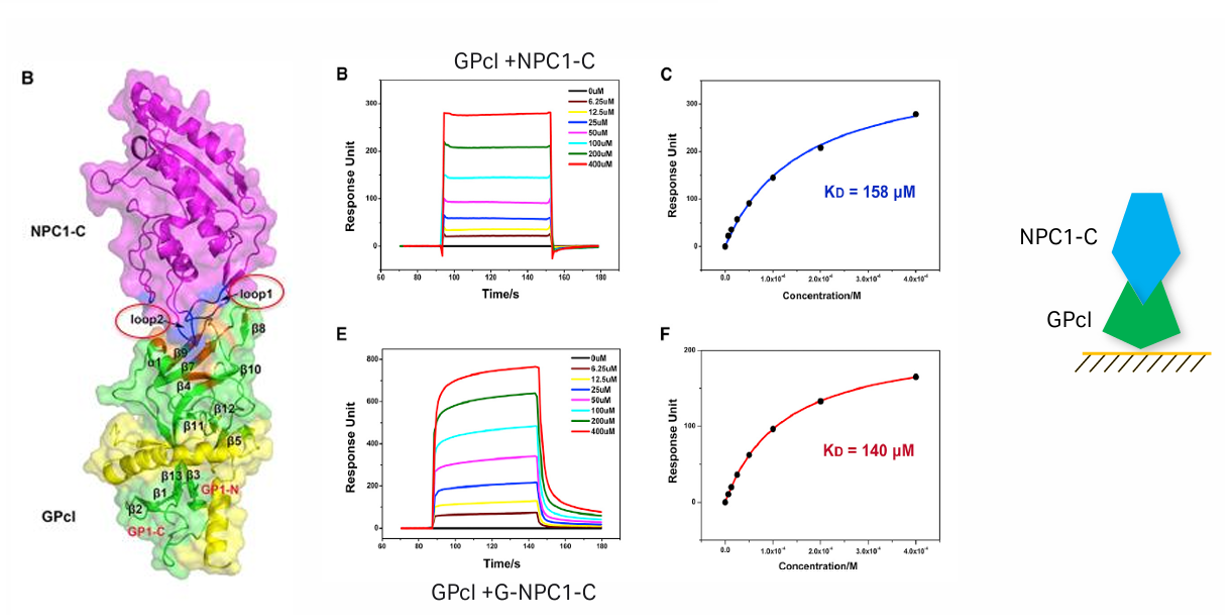
(数据来源:Wang H , et al. Cell. 2016)
蛋白质-核酸相互作用:
OsPAL6、OsPAL8基因启动子&转录因子OsMYB30
褐飞虱(Brown planthopper, BPH)是影响水稻(Oryza sativa L.)生产的最具破坏性害虫之一。苯丙氨酸解氨酶(Phenylalanine ammonia-lyase, PAL)是植物抵御病原体过程中的关键酶,但该酶在植物抗虫性中的作用尚不清楚。2019年袁隆平院士与万建民院士团队发现:“褐飞虱取食会显著诱导水稻中大部分PAL基因(OsPALs)的表达,沉默OsPALs基因会显著降低水稻对褐飞虱的抗性,而在感虫水稻品种中过表达OsPAL8基因,则会显著增强其对褐飞虱的抗性”。研究表明“苯丙氨酸解氨酶(PAL)相关基因(OsPAL6、OsPAL8)的表达水平受水稻中的R2R3 MYB转录因子OsMYB30的直接上调调控”。最终研究结果证实:“苯丙烷代谢途径在水稻对褐飞虱的抗性反应中发挥重要作用,同时为水稻褐飞虱抗性的遗传改良提供了宝贵的靶标基因”。
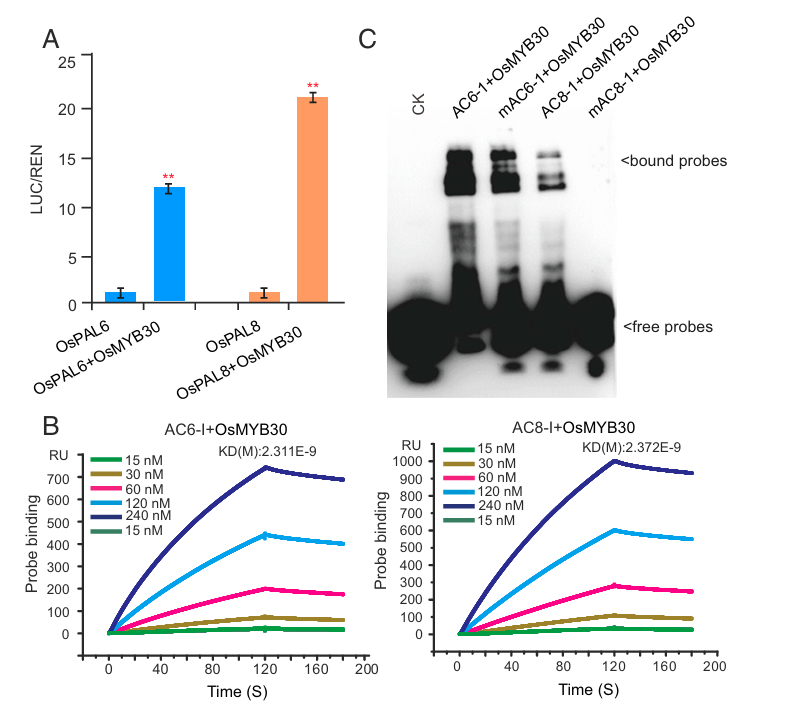
(数据来源:He J , et al. Proc Natl Acad Sci U S A . 2019)
蛋白质-多糖/脂质相互作用:
a)荚膜多糖CPS&乙酰化荚膜酯酶
王哲等人采用SPR技术研究了肺炎克雷伯菌荚膜多糖(CPS)与乙酰化荚膜酯酶(KpACE)间的相互作用。该SPR平台实验时间短、样本消耗少,并可模拟生理环境,高效适用于碳水化合物-蛋白质互作研究。他们成功验证KpACE作用于CPS的乙酰基团,揭示其酶活性和催化位点,为阐明细菌致病机制及开发抗菌药物提供了关键依据。该方法灵敏度高、无需标记,可广泛用于快速筛选互作亲和力和酶底物研究。
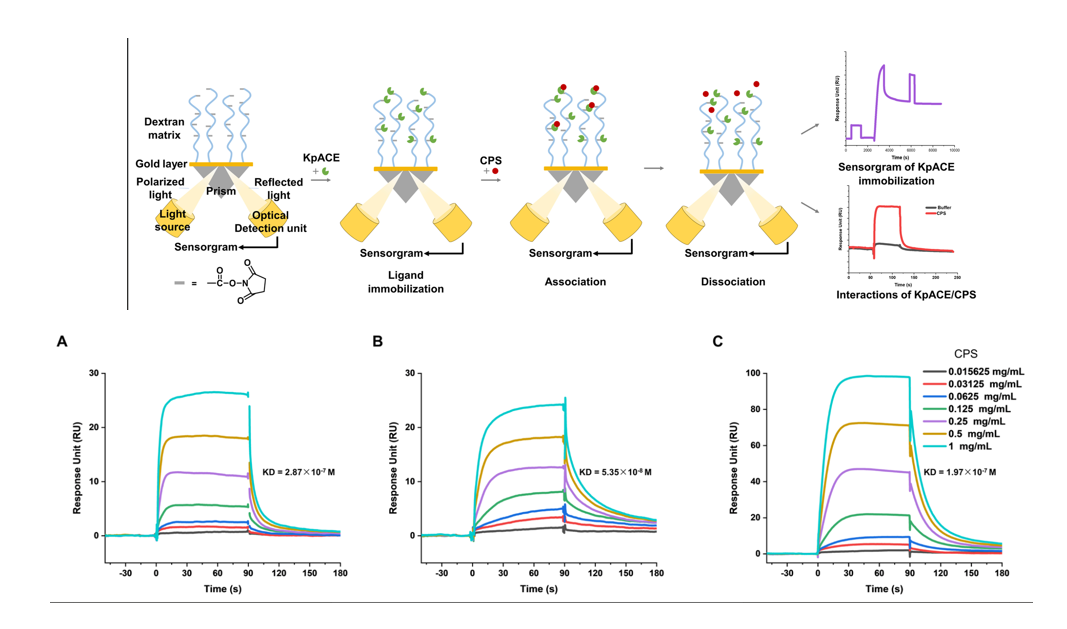
(数据来源:Wang Z , et al. Bio Protoc. 2025)
b)抗菌蛋白&脂多糖LPS
脂质与蛋白质的相互作用是生物膜体系中的关键事件。评估蛋白质-脂质结合的亲和力和特异性,能够为阐明细胞膜功能提供有用信息。Baron OL等人描述了一种抗菌蛋白(用作配体)经胺偶联固定到羧甲基(CM)传感芯片后,与脂多糖(LPS,用作分析物)的结合过程。
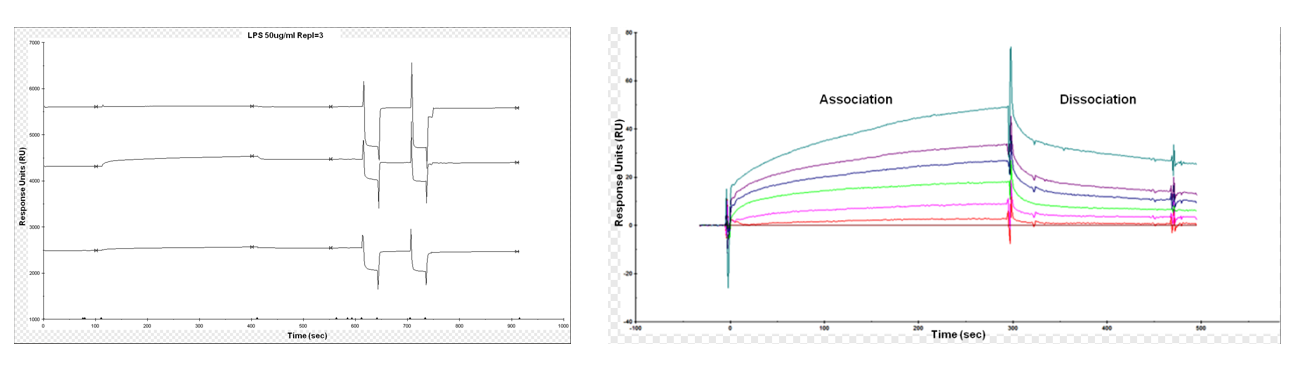
(数据来源: Baron OL , et al. Bio Protoc. 2014)
蛋白质-短肽相互作用:
Eiji Ishii等人成功建立了基于SPR的蛋白质-肽段相互作用检测方法,包括配体固定化、分析物结合测定和数据分析步骤,适用于定量研究肽段与蛋白质之间的亲和力和动力学参数。
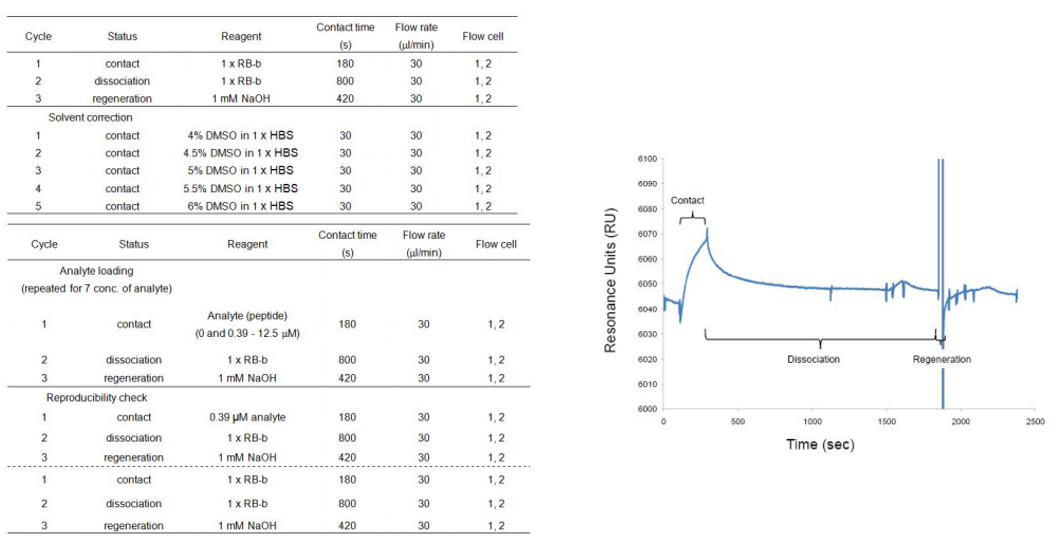
(数据来源:Eiji Ishii , et al. Bio Protoc. 2013)
蛋白质-小分子相互作用:
a) 小分子药物&E3连接酶衔接蛋白SPOP:
2016年中科院上海药物所郭忠强等人针对透明细胞肾细胞癌(ccRCC)中SPOP蛋白的异常(在细胞质中过表达而非细胞核)会促进肿瘤生长的问题,成功设计并优化出了一种小分子抑制剂。该抑制剂的核心机制是通过抑制SPOP与其底物蛋白的相互作用,来阻断致癌信号通路。最终结果显示该抑制剂能有效杀死癌细胞且对正常细胞影响极小,为治疗这种癌症提供了新的潜在疗法。
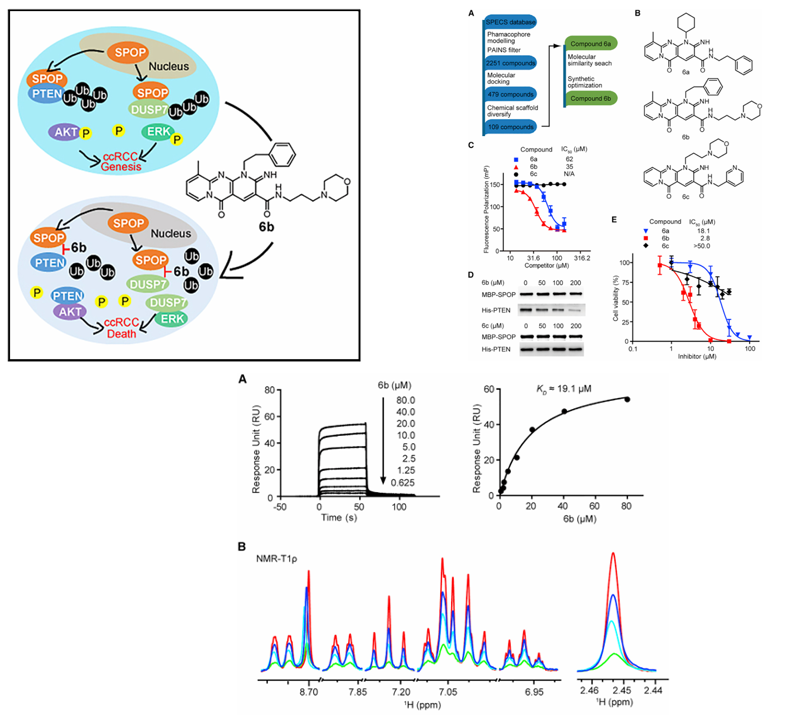
(数据来源:Guo ZQ , et al.Cancer Cell. 2016)
b) 三萜类化合物&病毒融合蛋白:
2018年北京大学司龙龙团队报道了一类天然三萜类化合物,可靶向作用于Ⅰ类病毒融合蛋白中保守的七肽重复序列2(HR2,一种优势α螺旋结构),进而拮抗其发夹三聚体的形成。该类化合物能抑制埃博拉、马尔堡、HIV及甲型流感病毒等多种病毒的入侵,其活性与HR2序列特征相关。通过氨基酸取代、表面等离子体共振及核磁共振等技术,研究鉴定出六个关键残基,揭示了三萜通过结合HR2疏水螺旋、阻断HR2-HR2互作以抑制发夹结构形成的分子机制。该机制在HIV和流感病毒中均得到验证,提示三类化合物可能作为广谱抗病毒策略,为病毒融合机制的调控提供了新视角。
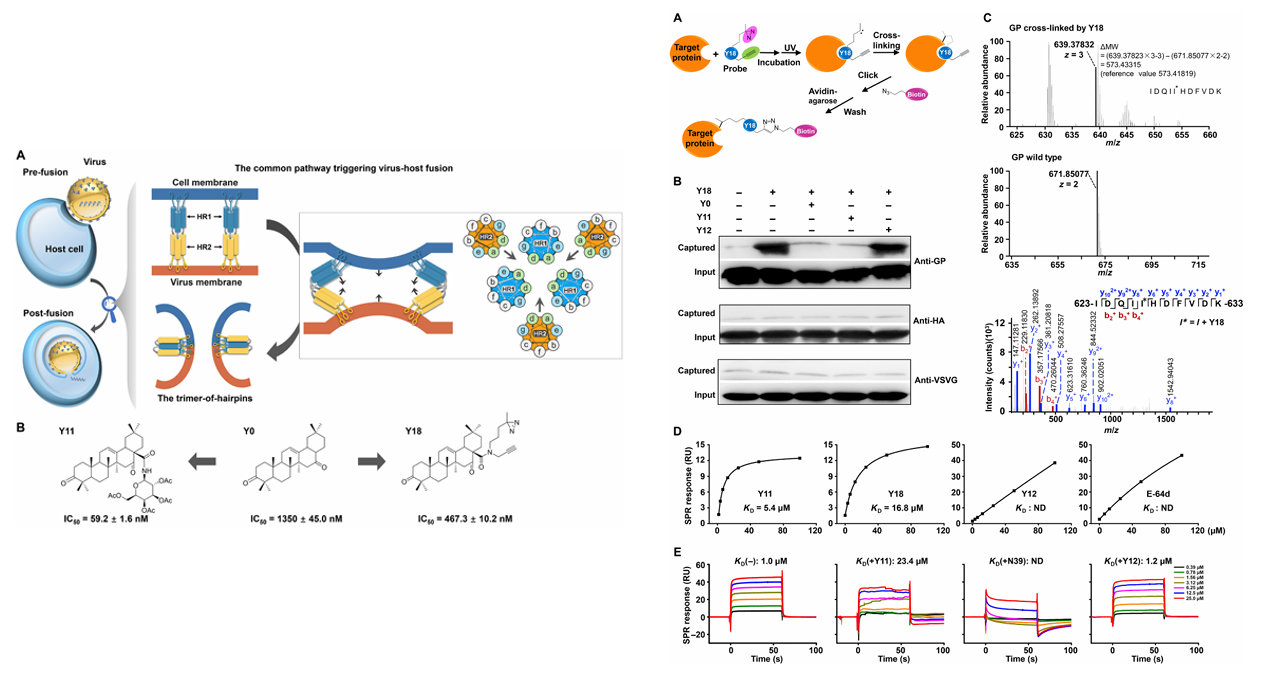
(数据来源:Si L , et al. Sci Adv. 2018)
抗原与抗体相互作用:
a)抗原&抗体
Nguyen K等人开发了一种利用常微分方程组分析1:2结合动力学数据的方法。该方法的突出特点包括对参数初始化进行网格搜索,以及采用轮廓似然法判断参数可识别性。运用该方法,他们在标准实验设计下采集的一个数据集中发现了一个不可识别的参数。经模拟指导优化的实验设计,实现了对所有速率常数的可靠估算。
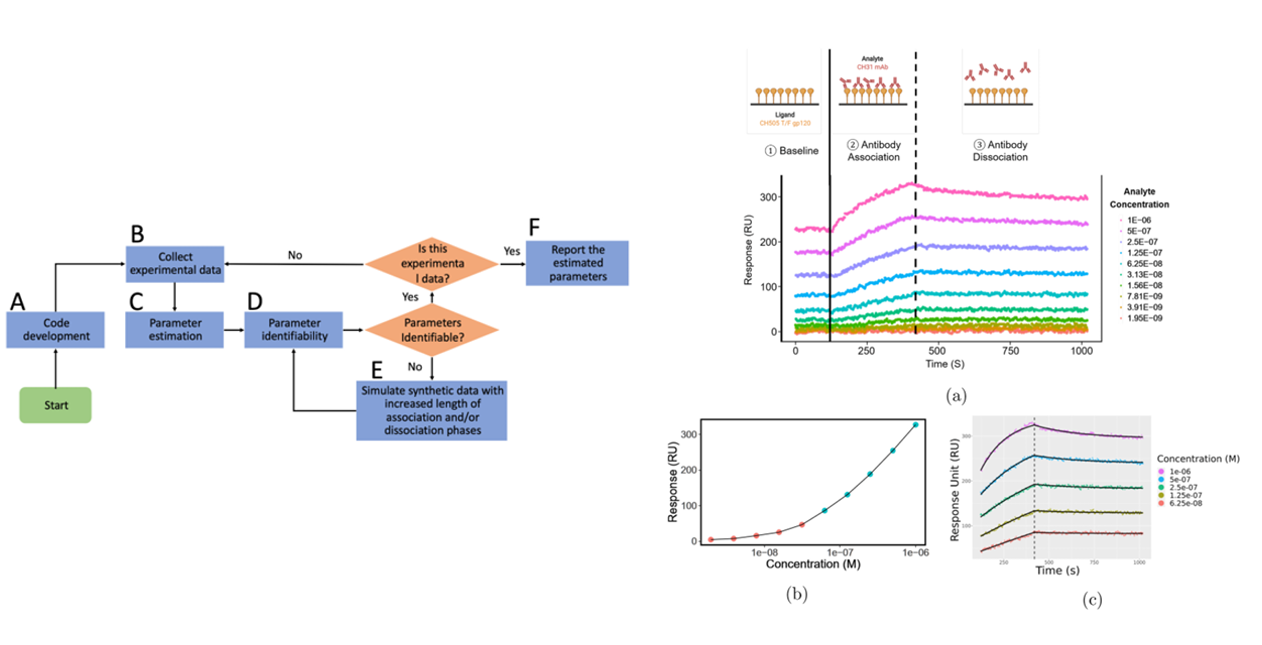
(数据来源:Nguyen K , et al. Anal Biochem. 2023)
b)杂交瘤样本&抗原:
Dorin MN等人采用Biacore T100系统,通过SPR技术分析粗提杂交瘤样品与蛋白质的亲和力。该方法首先通过酰胺偶联将抗IgG抗体共价固定于CM5芯片,进而利用Fc区域非共价捕获杂交瘤上清液中的抗体,实现定向结合。为减少基线漂移,使用EDC/NHS交联稳定复合物。通过多浓度下的相互作用监测及动力学分析,获得KD值以评估亲和力。该策略避免了二价抗体的亲和作用,可直接分析未纯化样品,并实现稳定的特异性抗体捕获。
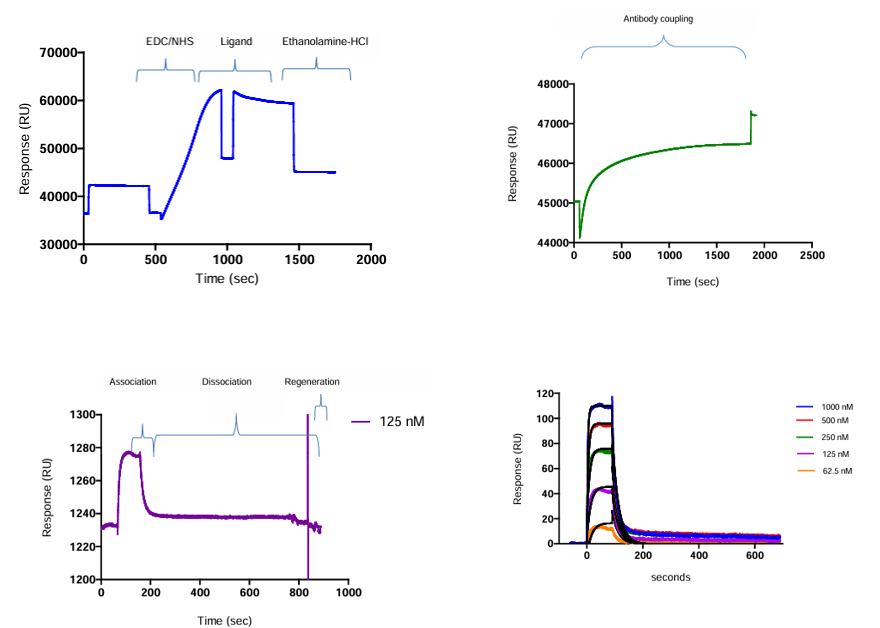
(数据来源:Dorin MN , et al. Bio Protoc. 2014)
c)新冠病毒&中和抗体:
2019年冠状病毒病(COVID-19)疫情由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引发,已在全球范围内传播。需要采取应对措施来治疗疾病并阻止病毒的进一步传播。2020年中科院微生物所史睿团队从康复患者体内分离出两种高效中和单克隆抗体CA1和CB6。研究显示,CB6在体外和恒河猴模型中均能显著抑制SARS-CoV-2感染。结构分析表明,CB通过靶向病毒RBD上与ACE2结合位点重叠的表位,竞争性阻断病毒-受体相互作用。这些结果凸显了CB6作为临床候选药物的潜力,值得进一步开发。
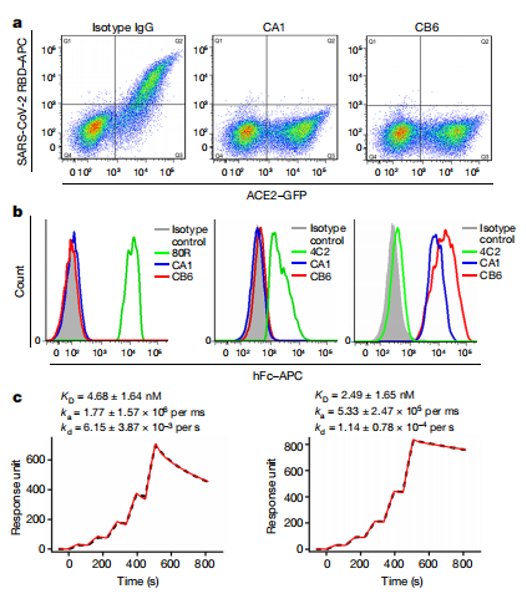
(数据来源:Shi R, et al. Nature. 2020)
武汉迈思生物基于已有重组蛋白和单B细胞重组兔单抗开发筛选平台,技术团队核心成员拥有多年的蛋白质研究、生物大分子互作分析及蛋白质表征分析研究经验,公司建立了严谨的方法开发优化流程,并通过了ISO9001质量管理体系,确保每一项检测实验都能获得最佳的检测结果。目前对外提供蛋白互作、抗体筛选等亲和力检测服务。

更多服务及产品内容欢迎咨询了解。
