信号调节蛋白α(Signal Regulatory Protein Alpha,SIRPA),是一种Ⅰ型跨膜蛋白,核心功能是通过SIRPA-CD47轴传递“别吃我”信号,抑制巨噬细胞的吞噬活性和炎症反应,从而维持自身免疫耐受和稳态。靶向该通路为癌症等疾病的治疗提供了新的方向。SIRPA的表达分布
SIRPA普遍在大脑中高表达。在髓细胞上可检测到,但在T细胞上检测不到。在心脏、胎盘、肺、睾丸、卵巢、结肠、肝脏、小肠、前列腺、脾脏、肾脏、骨骼肌和胰腺中检测到的水平较低。
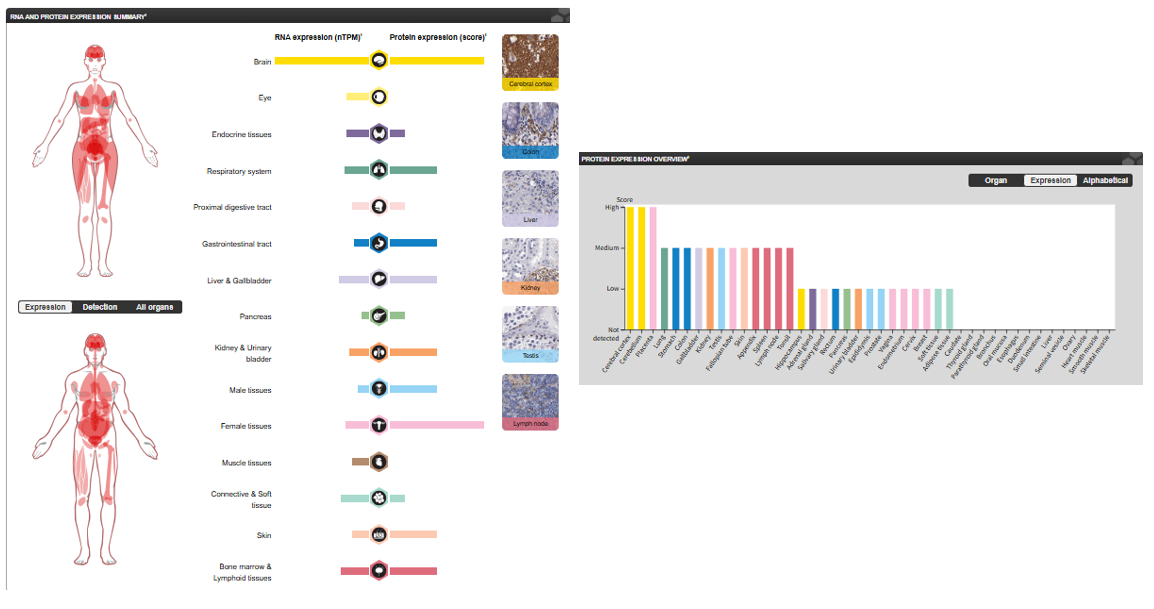
(数据来源:proteinatlas)
SIRPA的结构
SIRPA是由SIRPA基因编码的长度为504 aa,分子量约54.9 kDa的Ⅰ型跨膜蛋白,由胞内区,跨膜区和胞外区三个部分组成,SIRPA的核心功能是作为一个抑制性受体,通过与其配体CD47的相互作用,向下游传递“别吃我”的信号。
胞外区(31-373 aa):包含三个免疫球蛋白超家族结构域,分别为V(可变区样)、C1(恒定区1样)和C2(恒定区2样)。其V结构域是核心功能域,负责与配体CD47结合。SIRPα的V结构域在不同个体间具有多态性,这意味着其氨基酸序列存在变异,这可能影响其与CD47的结合亲和力,并与个体对某些疾病的易感性或同种异体移植排斥反应有关。
跨膜区(374-394 aa):由一个α螺旋组成,其主要功能是将受体锚定在细胞膜上,并将胞外区的构象变化传递到胞内区。
胞质区(395-504 aa):包含免疫受体酪氨酸抑制基序(ITIMs)。在人源SIRPα中,通常有两个ITIM基序。当胞外区与CD47结合后,ITIMs中的酪氨酸残基会被磷酸化,从而招募并激活含有SH2结构域的蛋白酪氨酸磷酸酶(如SHP-1和SHP-2)。这是传递抑制性信号的关键步骤。
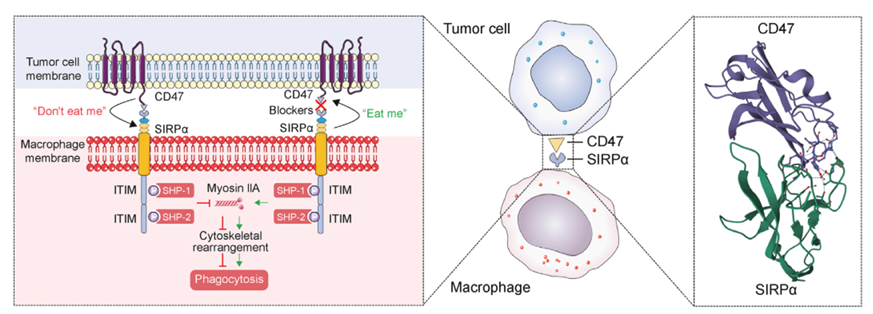
(数据来源:Che Z, et al. J Pharm Anal. 2025)
SIRPA的信号通路
信号源(配体):CD47广泛表达于正常健康细胞,如红细胞、淋巴细胞等;许多癌细胞也会高表达CD47以逃避免疫监视。
受体:SIRPA主要表达于髓系细胞,如巨噬细胞、树突状细胞,以及神经元。
关键效应分子:含有SH2结构域的蛋白酪氨酸磷酸酶,主要是SHP-1和SHP-2。
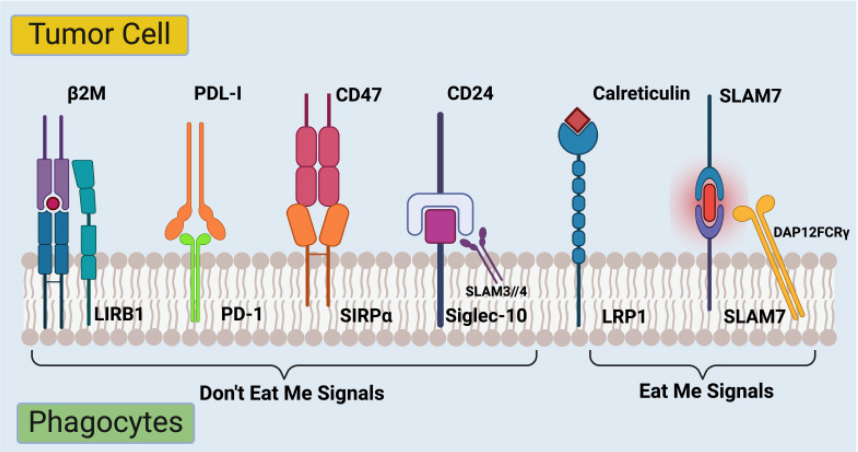
(数据来源:Zhao K, et al. Front Immunol. 2024)
SIRPA与疾病
免疫逃逸:许多癌细胞会高表达配体CD47,与巨噬细胞等髓系免疫细胞上的SIRPα大量结合,过度激活抑制性信号通路。巨噬细胞的吞噬功能被强烈抑制,导致癌细胞逃脱天然免疫系统的监视和清除,促进肿瘤的生长和转移。SIRPα-CD47轴已成为一个重要的癌症免疫检查点。
胃肠道癌(gastrointestinal GI cancer)领域:CD47-SIRPα是肿瘤免疫中的重要检查点。肿瘤细胞通过高表达CD47,结合巨噬细胞等免疫细胞表面的SIRPα,传递“别吃我”信号,实现免疫逃逸。使用抗CD47抗体、SIRPα-Fc融合蛋白或双特异性抗体等阻断该通路,可解除抑制作用,促进巨噬细胞通过ADCP吞噬肿瘤,并增强NK细胞介导的ADCC效应。同时,肿瘤抗原释放可激活树突状细胞和T细胞,引发特异性免疫应答。此外,CAR-T/M细胞靶向CD47及补体激活也强化了抗肿瘤效果。
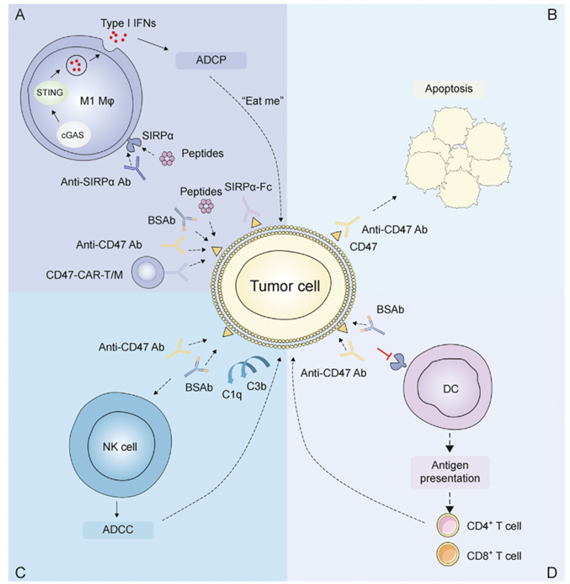
(数据来源:Che Z, et al. J Pharm Anal. 2025)
高危神经母细胞瘤(High-Risk Neuroblastoma)领域:巨噬细胞(M1-M1间、肿瘤细胞-巨噬细胞间)通过 CD47-SIRPA结合,传递 “别吃我”信号,抑制吞噬功能,帮助肿瘤逃逸。神经母细胞瘤(NB)通过 CD47与巨噬细胞SIRPA结合,传递“别吃我”信号,直接抑制M1型巨噬细胞(M1为促炎型)的吞噬。抗CD47抗体一方面阻断 肿瘤细胞CD47-巨噬细胞 SIRPA 结合,解除“别吃我”信号;另一方面与巨噬细胞 FcγR结合,传递“别吃我”信号,激活M2型巨噬细胞(M2为抑炎/促肿瘤型)向促吞噬表型转化,增强对NB的吞噬。通过Anti-SIRPA F(ab’)₂ 阻断CD47-SIRPA结合,使M1型巨噬细胞恢复对NB的吞噬功能。
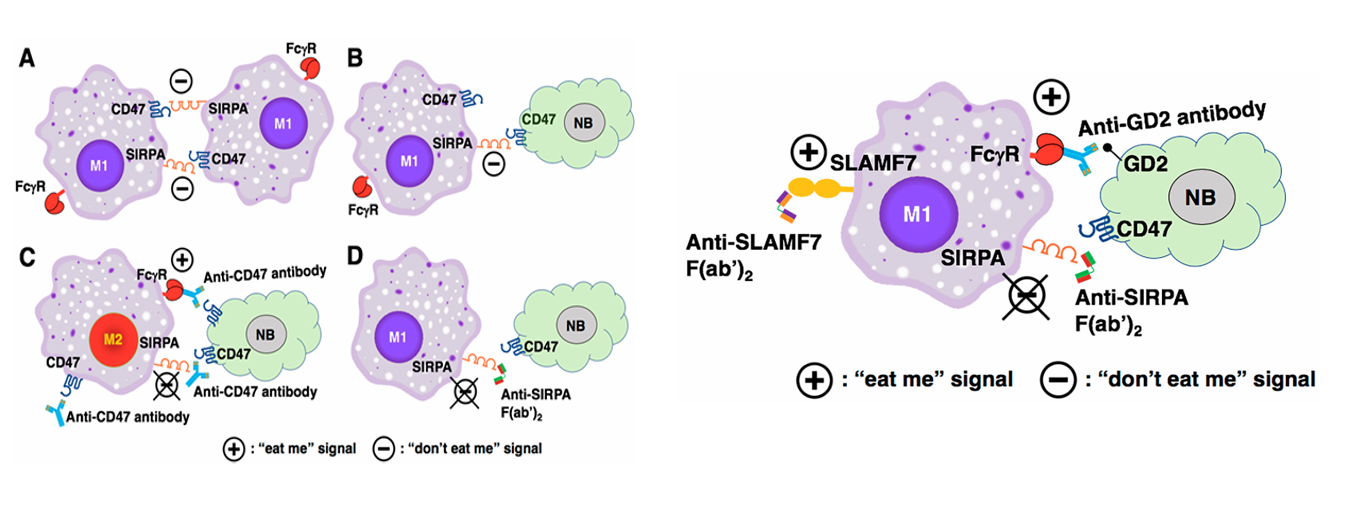
(数据来源:Tang XX, et al. Curr Oncol. 2024)
结直肠癌(colorectal cancer)领域:a)在肿瘤微环境中,TAMs(肿瘤相关巨噬细胞)中未折叠蛋白反应/内质网-XBP1(UPR/ER-XBP1)信号通路的激活会诱导细胞因子产生,这些细胞因子通过破坏自身识别,抑制巨噬细胞对肿瘤细胞的吞噬作用。因此,TAMs会促进结肠癌的转移。b)破坏UPR/ER-XBP1信号通路或使用Anti-SIRPα抗体治疗,可能在恶劣的肿瘤微环境中增强抗癌能力。
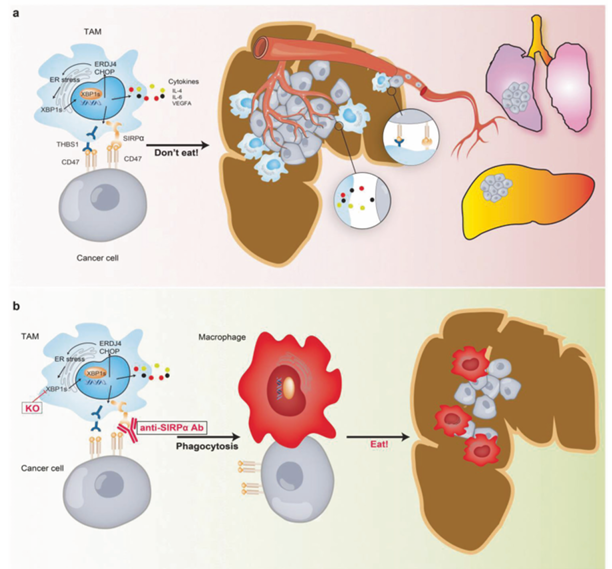
(数据来源:Zhao Y, et al. Signal Transduct Target Ther. 2021)
SIRPA的靶向治疗
始于CD47–SIRPα互作(1999–2000)的发现,奠定“自我”识别基础。2007–2014年间,研究聚焦“自我/非我”识别机制,如钙网蛋白、SIRPα及MHC-I/LIRB1等被确认为吞噬检查点。2015年后领域迅速扩展、涵盖补体依赖的肿瘤杀伤、PD-L1、CD24/CD22/STC1/IGSF8/ENPP1/TREX1等新检查点分子,以及协同治疗策略和cGAS/STING通路相关调控。这些进展系统揭示了吞噬作用的调控网络,为靶向吞噬检查点的肿瘤免疫治疗奠定了坚实基础。
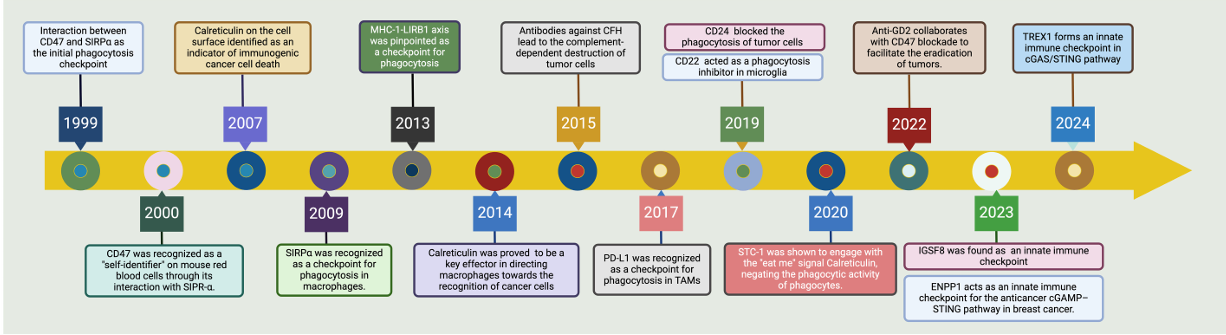
(数据来源:Zhao K, et al. Front Immunol. 2024)
BSI-082是由博奥信生物技术(南京)有限公司研发的一款靶向SIRPA的单克隆抗体药物。其主要的作用机制是作为SIRPA的抑制剂和巨噬细胞刺激剂,抑制SIRPα并直接刺激吞噬细胞功能,用于治疗局部晚期恶性实体瘤。于2025年8月7日批准1期临床试验。
ELA-026是由Electra Therapeutics研发的一款靶向SIRPA、SIRPβ1、SIRPγ和Tubulin的单克隆抗体药物。其主要的作用机制是作为SIRPα调节剂,同时调节SIRPβ1和SIRPγ,并抑制微管蛋白功能,用于噬血细胞性淋巴组织细胞增多症(sHLH)。于2022年5月19日批准3期临床试验。
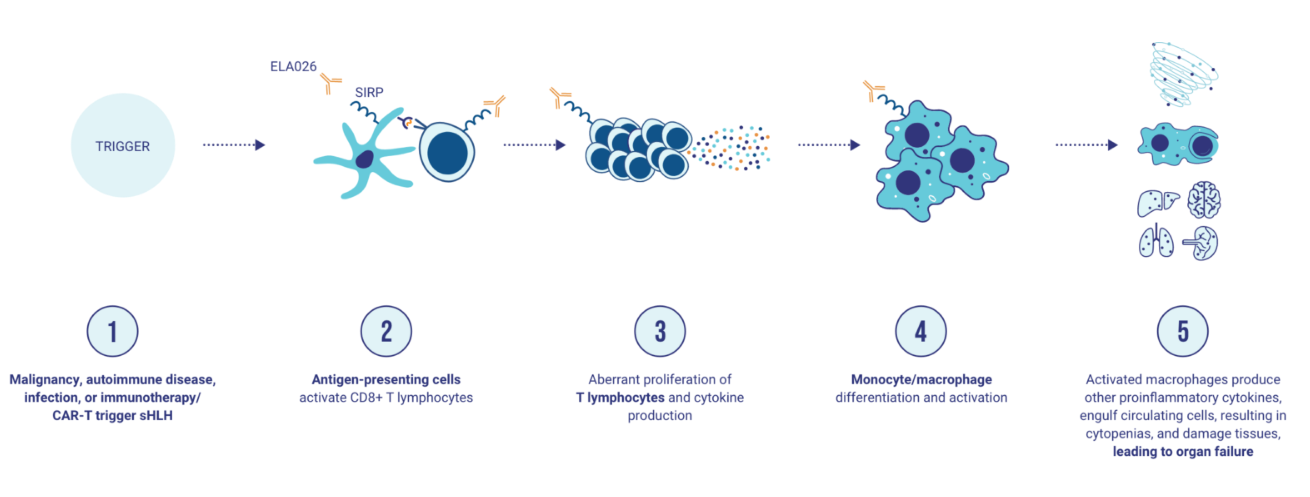
(数据来源:electra官网)
BI-770371是由Boehringer Ingelheim GmbH研发的一款靶向SIRPα和Chk的单克隆抗体药物。其主要的作用机制作为SIRPα的抑制剂,通过抑制SIRPα和Chk激酶,增强抗体依赖性细胞毒性(ADCC)并刺激T淋巴细胞活性,用于治疗晚期实体瘤。于2025年2月3日批准2期临床试验。
LM-101是由礼新医药科技(上海)有限公司研发的一款靶向SIRPα的单克隆抗体药物。其主要的作用机制是特异性抑制SIRPα,阻断其与CD47的相互作用,增强抗肿瘤免疫,用于治疗肝细胞癌和肥胖。于2023年1月11日批准2期临床试验。
JY47是由杭州九源基因生物医药股份有限公司研发的一款靶向SIRPα的单克隆抗体药物。其主要的作用机制是靶向SIRPα,阻断CD47-SIRPα信号轴以激活免疫系统,用于治疗晚期恶性实体瘤。于2025年7月1日批准1期临床试验。
(数据来源:SangYS, et al. Industrial Crops and Products. 2025)
ADU-1805是由Sairopa B.V研发的一款靶向SIRPα的单克隆抗体药物。其主要的作用机制是单克隆抗体靶向SIRPα,阻断免疫抑制信号通路,用于治疗晚期恶性实体瘤&转移性实体瘤。于2023年4月3日批准1期临床试验。
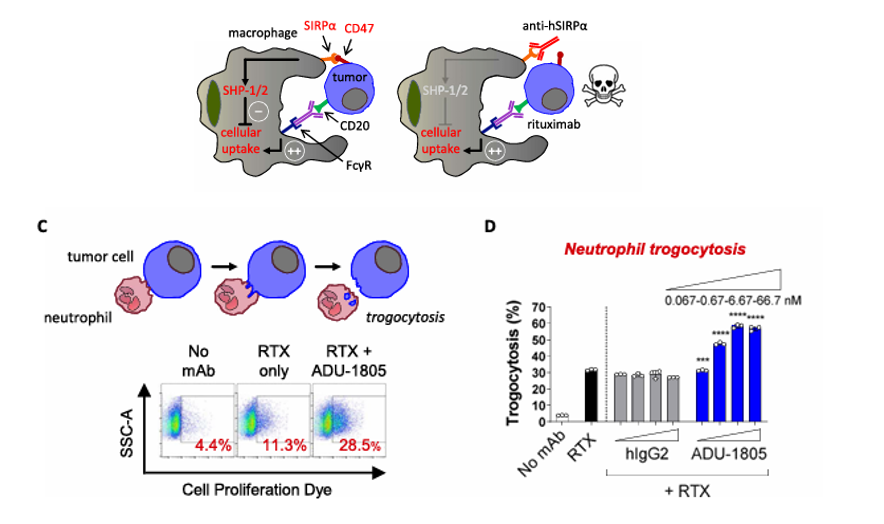
(数据来源:Voets E, et al. J Immunother Cancer. 2019)
ES004-B5是由科望(上海)生物医药科技有限公司研发的一款靶向SIRPα的单克隆抗体药物。其主要的作用机制是作为SIRPα抑制剂,用于治疗肿瘤。目前处于药物发现阶段。
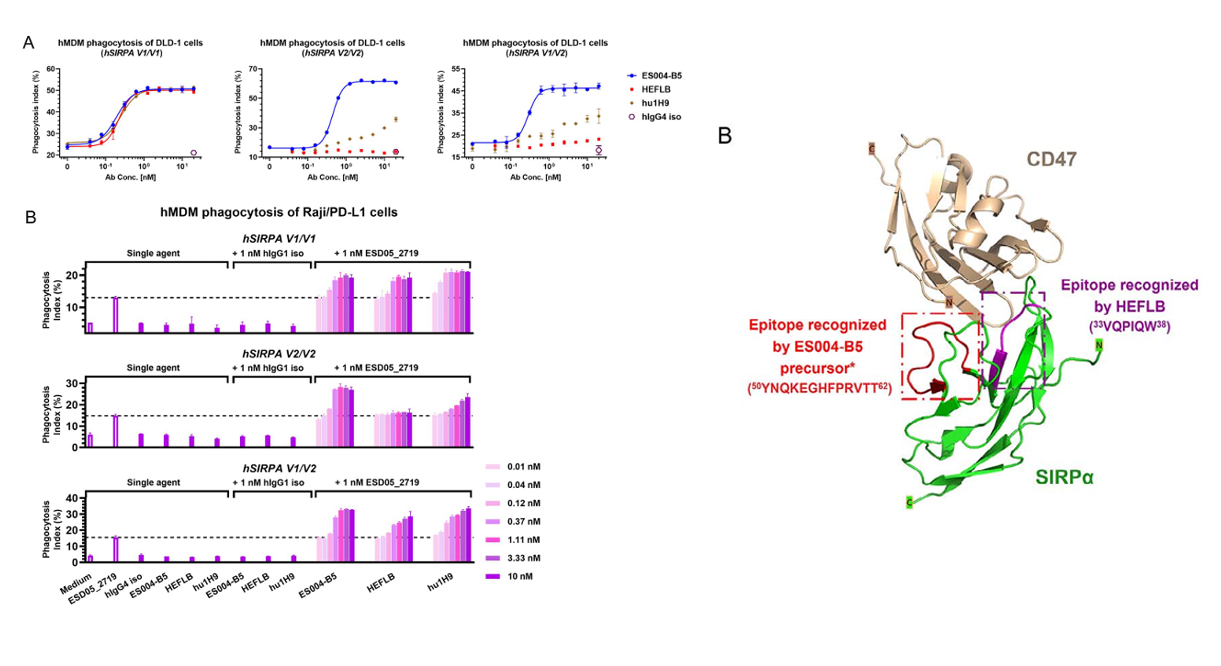
(数据来源:Niu X, et al. Antib Ther. 2024)
我们收集整理一批SIRPA相关抗体序列信息。文档可关注公众号,号内回复“ SIRPA ”下载。