血管粘附蛋白(VAP1)也称为氨基脲敏感型胺氧化酶(SSAO)或含铜胺氧化酶3(AOC3),在内皮细胞表面,它还可以作为细胞粘附蛋白,通过介导淋巴细胞与外周淋巴结血管内皮细胞的结合,以L-选择蛋白无关的方式参与淋巴细胞的渗出和再循环。它在炎症反应、血管疾病及纤维化进程中扮演着核心角色,已成为多种慢性疾病极具潜力的治疗靶点。

(数据来源 Bhattacharjee P,et al . Med Res Rev. 2025)
VAP1的表达分布
VAP-1在人体内广泛表达于血管系统。它主要定位于血管平滑肌细胞和内皮细胞的表面,尤其在淋巴结中的高内皮微静脉、肝脏血窦内皮以及肺、小肠、阑尾等血管化程度高的组织中表达水平显著。
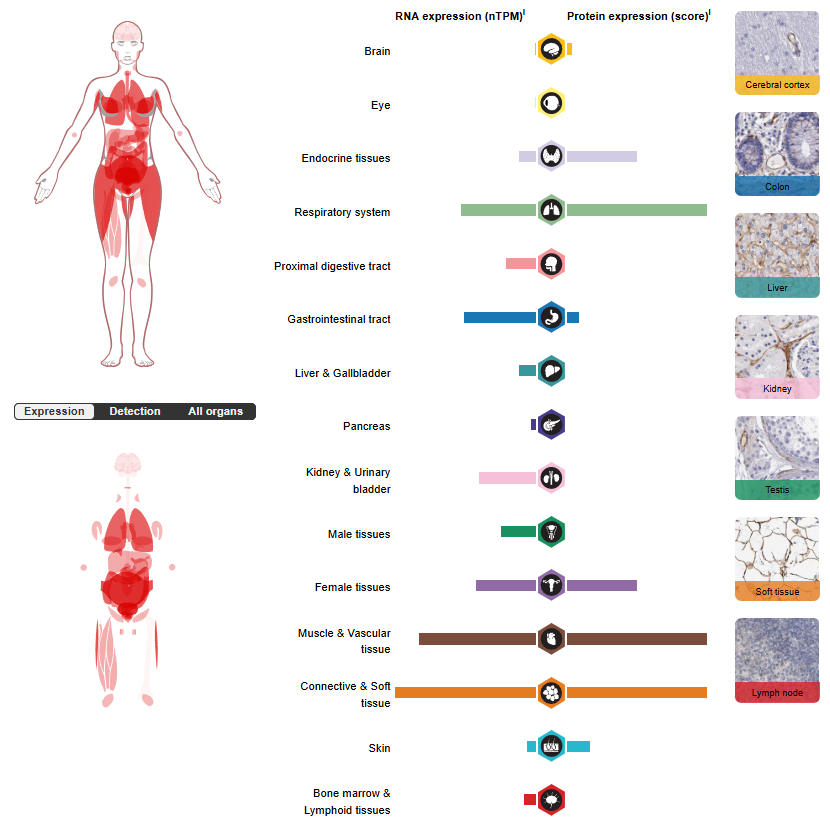
(数据来源 uniprot)
VAP1的结构和其受体
VAP-1是一个Ⅱ型跨膜糖蛋白,其独特的结构是其兼具粘附分子和氧化酶双重功能的物质基础。
基本结构包括一个很短的胞内尾区、一个单次跨膜结构域和一个庞大的胞外结构域。这个胞外结构域高度糖基化,并包含了酶的活性中心。
活性中心与催化机制:VAP-1属于含铜胺氧化酶家族。其活性中心含有铜离子(Cu²⁺) 和一个由特定酪氨酸残基氧化后形成的醌辅因子。该酶能够催化伯胺(如甲基胺)发生氧化脱氨反应,生成相应的醛、过氧化氢(H₂O₂)和氨。这一催化反应是其信号转导功能的关键。
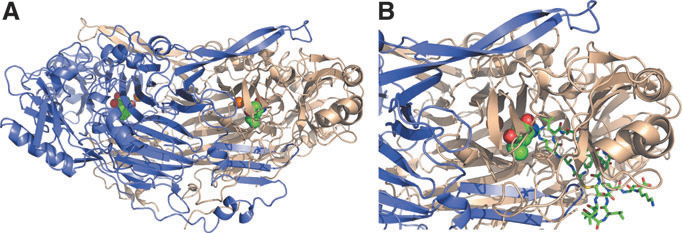
(数据来源 Salmi M, et al. Antioxid Redox Signal. 2019)
VAP1在心血管疾病中的作用
VAP-1是一种多功能黏附分子,在动脉粥样硬化(ASCVD)的发病机制中起着至关重要的作用。它通过调节炎症、诱导血管内皮损伤、调节糖脂代谢、改变斑块稳定性等发挥作用。大量研究证实VAP-1与ASCVD的发生和预后密切相关。
血管炎症诱导VAP-1转位至内皮管腔表面,随后VAP-1与Siglec-9/10(唾液酸结合免疫球蛋白样凝集素9/10)相互作用,介导单核细胞浸润至动脉粥样硬化病变。同时,VAP-1的酶促产物,如H2O2,可能进一步增加VAP-1在内皮细胞上的表达和随后的单核细胞迁移。炎症早期病变刺激中膜平滑肌细胞从静止的“收缩”表型状态转变为增殖、迁移和胶原合成增加的活跃的“合成”状态。平滑肌细胞质膜上的VAP-1可能通过其酶促产物抑制其表型转换,从而限制平滑肌细胞和胶原组成的纤维帽的生长。因此,VAP-1是斑块不稳定的病理因素,其特征是薄纤维帽覆盖在富含单核/巨噬细胞源性泡沫细胞的大脂质核心上。

(数据来源 Chen C, et al. Front Cardiovasc Med. 2025)
VAP1的靶向治疗
Timolumab(BTT1023)是一种靶向VAP1的单克隆抗体,首先由Biotie Therapies(现在的Acorda)及其合作伙伴开发。用于治疗原发性硬化性胆管炎,目前处于临床2期研究阶段。Timolumab可抑制VAP-1,VAP-1被认为是通过促进白细胞聚集并侵入炎症部位而引起炎症。传统抗炎药抑制炎症物质的产生或抑制其作用,而SI-3106独特地作用于控制白细胞运动的黏附分子。已被发现在治疗银屑病和类风湿关节炎(NCT00871598和NCT00851240)方面安全有效。一个多中心、开放标签、单臂实验来确定BTT1023治疗的安全性、药代动力学和有效性(NCT02239211)。银屑病和类风湿关节炎的早期临床研究均显示其耐受性良好且有效。相反,在19例原发性硬化性胆管炎患者中进行的II期研究在中期分析后停止,因为实验没有达到预先确定的有效性要求。

(数据来源 seikagaku官网)
我们收集整理一批VAP1相关抗体序列信息。文档可关注公众号,号内回复“VAP1”下载。
