背景
深度学习极大地推进了高度稳定的静态蛋白质结构的设计,然而,模仿天然开关蛋白(具有受控的、信号传导所需的构象变化/动力学)的可控构象动力学,仍然是无法从头设计的难题。该研究提出了一种通用且实现蛋白质原子级精度动态变化的深度学习指导方法,用于从头设计蛋白质结构域内在不同构象之间进行动态变化。
2024年7月美国加州大学旧金山分校的Amy B. Guo在Science上发表了一篇名为“Deep learning-guided design of dynamic proteins”的研究型论文,该研究通过深度学习的指导方法解决了4个结构验证设计的构象之间的微秒转换,并证明构象景观可以通过正构配体(如:酶的催化口袋、受体的配体结合位点等蛋白的天然功能核心区域)和变构突变(如:表面残基、非直接接触区域等远离核心功能区域的远程位点)来进行调控。a)正构配体可直接结合功能区,改变局部构象;b)变构突变通过残基相互作用网络间接传递影响(如氢键、疏水堆积的远程耦合)。基于物理的模拟与深度学习预测和实验数据非常一致,揭示了不同的状态依赖性残基相互作用网络,并预测了调整设计构象景观的突变。他们的方法表明,新的运动模式如今可通过从头设计实现,为构建受生物启发、可调控且可控的蛋白质信号行为提供了框架。
蛋白质构象变化的生物学功能
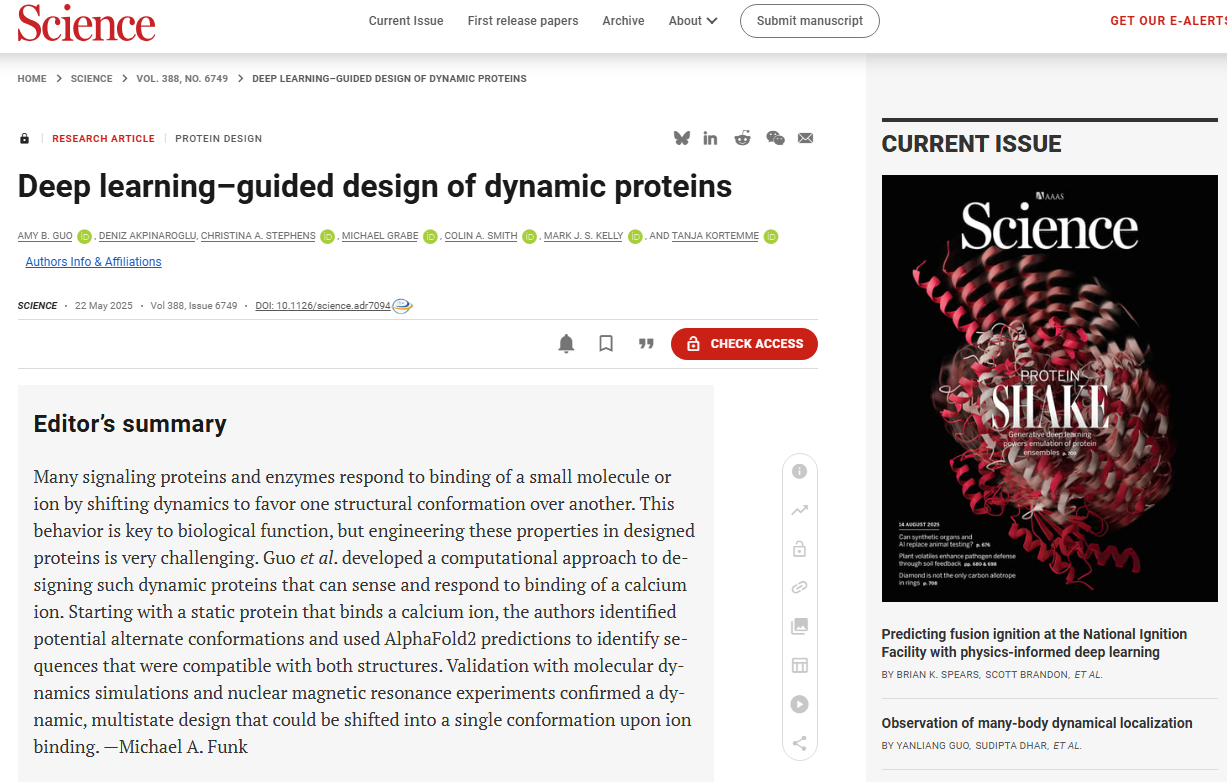
天然蛋白质中,结构域内的构象变化十分常见,且对功能调控至关重要,包括分子识别,信号传导和酶催化。构象状态数量与转换由能量景观的相对自由能和它们之间的势垒所决定。伴侣、环境、翻译后修饰及变构效应物也可通过调控活性/非活性构象群体调节功能,计算设计的突变也能改造构象景观与功能。例如,已知螺旋会经历扭转、弯折、滑动等多种运动模式,以实现不同功能:如形成活性催化位点(如激酶中αC螺旋的旋转,下图左,Cα原子均方根偏差(RMSD)=6.4Å)、结合下游信号分子(如G蛋白偶联受体(GPCR)中TM6螺旋的弯折,以允许G蛋白偶联,下图中,Cα RMSD=6.9Å),以及调节孔道直径(如核孔蛋白中螺旋的滑动,下图右,Cα RMSD=5.7Å)。
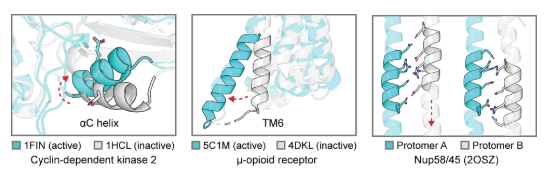
具有可调控双态平衡的动态蛋白质设计方法
该研究开发了一种通用设计策略,用于构建具有多能量最小值的蛋白质序列,每个最小值对应特定构象状态(下图A)。重点设计了二级结构元件的域内构象重排(模拟天然信号蛋白的核心机制),并通过正交配体(结合构象变化区)和别构扰动(作用于远端位点)实现构象平衡调控。设计流程包含三个阶段(下图B):a)通过物理原理构象采样生成候选状态库,并评估各状态的可设计性; b)利用深度学习引导序列-结构空间搜索,识别关键残基并设计多状态兼容序列;c)整合模拟与深度学习预测状态特异性网络,筛选可调控构象切换的突变。该研究以工程化Ca²⁺结合蛋白(源自肌钙蛋白C N端结构域)为概念验证(下图C)。采用E41A突变体(PDB: 1SMG)作为起始状态,其位点I亲和力降至毫摩尔级而位点II保持微摩尔亲和力,且突变体本身无Ca²⁺依赖构象变化。该方案证明了将可控构象变化引入天然蛋白质的普适性,也可从头设计结合能力状态。
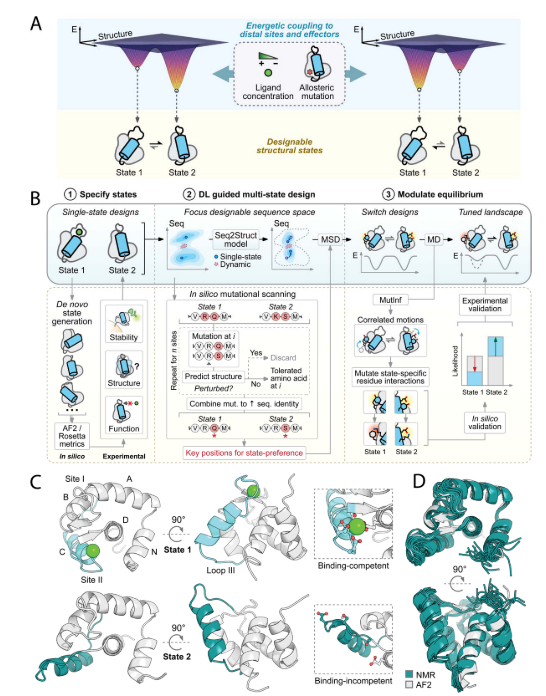
从头设计替代态的产生和实验验证
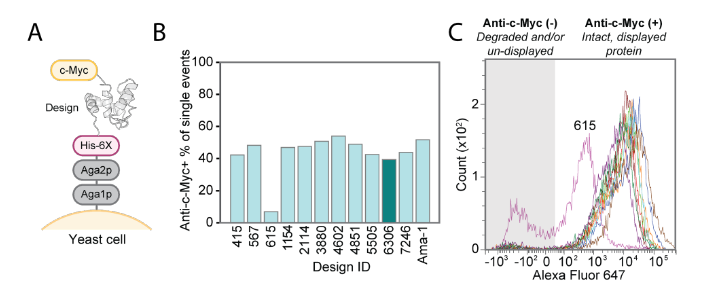
该研究采用LUCS算法对含环III、螺旋C和Ca²⁺结合位点II的蛋白片段采样,生成与状态1几何差异化的状态2构象。采样允许二级结构动态转换(环-螺旋互换),模拟天然构象变化。通过Rosetta单态序列设计筛选约1,000候选模型(平均Cα RMSD 7.1 Å)。实验验证11种设计,其中10种(如#6306)在酵母展示中稳定。设计#6306的NMR结构与AlphaFold2预测高度吻合(Cα RMSD 0.98 Å),其螺旋C位移导致Ca²⁺结合位点II重组并丧失结合能力,成功实现非结合态(状态2)设计目标。
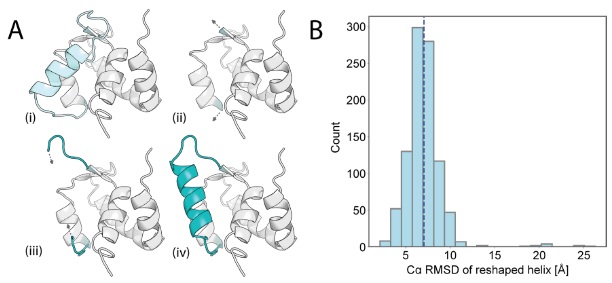
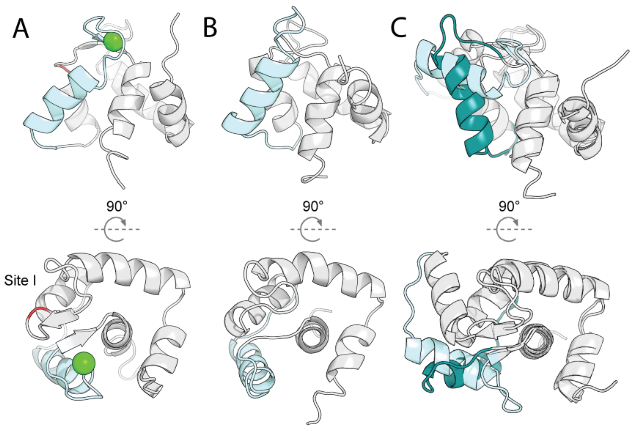
动态蛋白质的多态设计
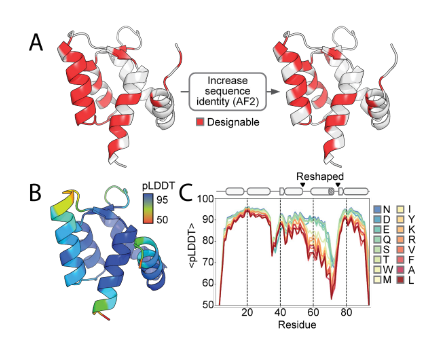
该研究旨在设计同时兼容蛋白构象状态1和2的多态序列。通过AlphaFold 2筛选关键残基(如溶剂可及区、氢键网络位点),将可设计残基数从37减至25;结合蛋白质MPNN生成双态兼容的高相似序列(仅15-18个突变)。确定残基89为变构核心:小体积氢键供体/受体(如Ser)通过稳定环III-螺旋D互作促进状态2;大体积疏水残基(如Leu)则推离环III而偏好状态1。AF2的pLDDT分析证实其可调控远端构象。该工作首次实现通过单点残基(89)化学特性微调精确控制蛋白多态构象分布,为动态蛋白工程提供新途径。

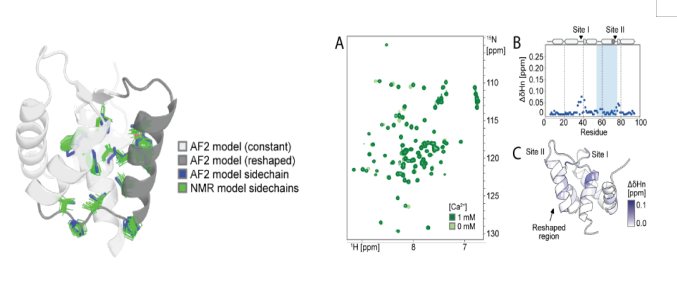
突变对构象景观的别构调节
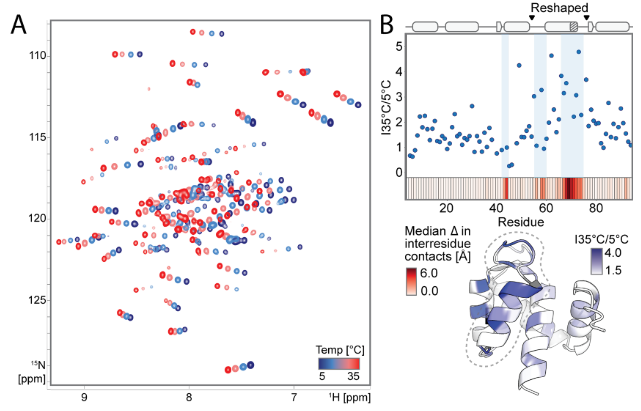
该研究为了验证设计的蛋白是否形成依赖89位氨基酸的两种预定构象 ,及构象动态变化规律。研究者们选取5个设计(覆盖AF2预测的“偏好状态2(S89、N89)、偏好状态1(I89、K89)、混合态(R89)”行为),利用NMR谱的方法,测¹H-¹⁵N HSQC谱,分析化学位移差异;并解析S89(偏好状态2)和I89(偏好状态1)的NMR结构,对比AF2预测;同时对I89采集5–35℃的温度依赖谱,结合旋转坐标系弛豫色散(R2),分析构象交换动力学。最终发现89位单残基突变(如I89→S89)导致重塑区域 67/92个主链酰胺化学位移剧变 ,N89的位移介于两态间,I89的重塑区域在低微秒时间尺度 发生两态交换,温度依赖的峰强变化和R2值支持该动态平衡。
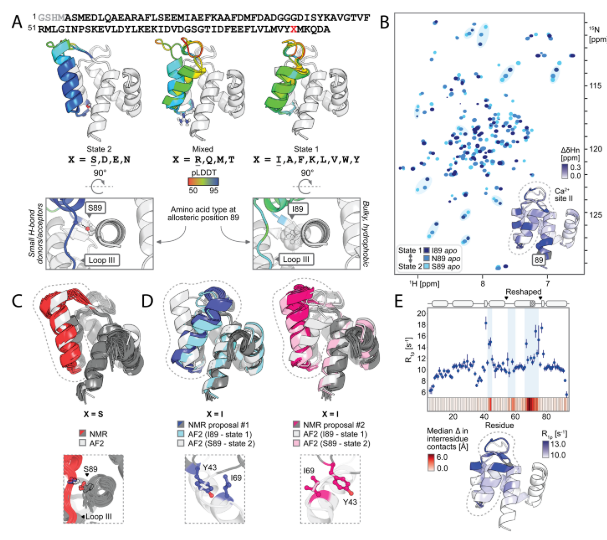
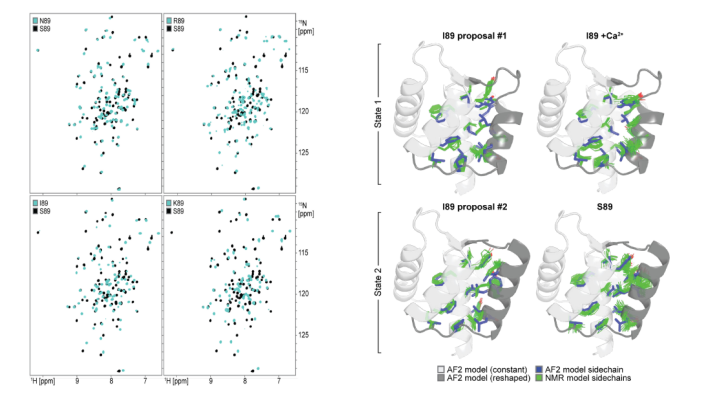
配体结合对构象景观的正构调节
为了探索Ca2+结合是否也通过优先稳定状态1来调节状态群体,研究者们记录了每个点突变体在有和没有Ca2+的情况下的1H,15 N-HSQC光谱。通过解析Ca2+结合下I89的NMR结构(holo结构),最终发现(1) Ca2+诱导重塑区域及相邻残基显著化学位移扰动,方向符合向结合态(状态1)的平衡移动; (2) holo I89结构与状态1模型高度一致,但仍观测到状态2的残余动态。结果表明设计的序列在溶液中可形成两种构象,丰度可被变构突变和Ca2+结合调控。
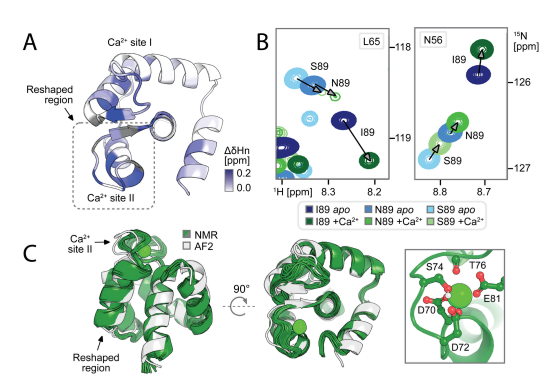
整合基于物理学的模拟以调整构象平衡
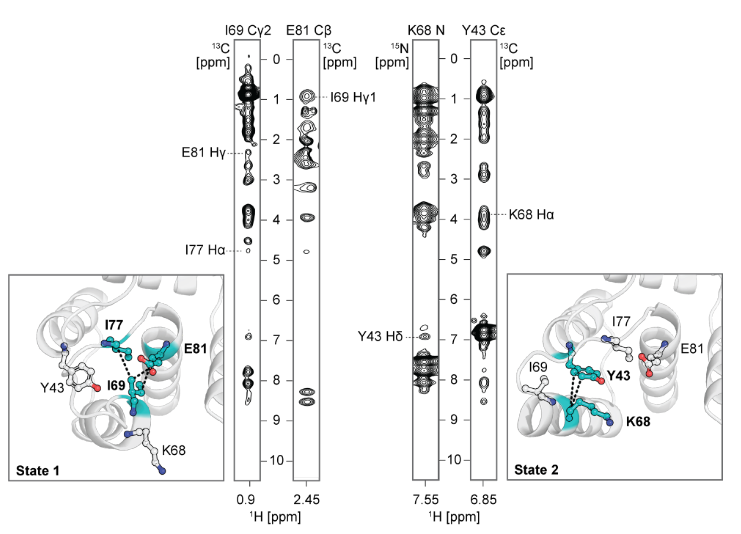
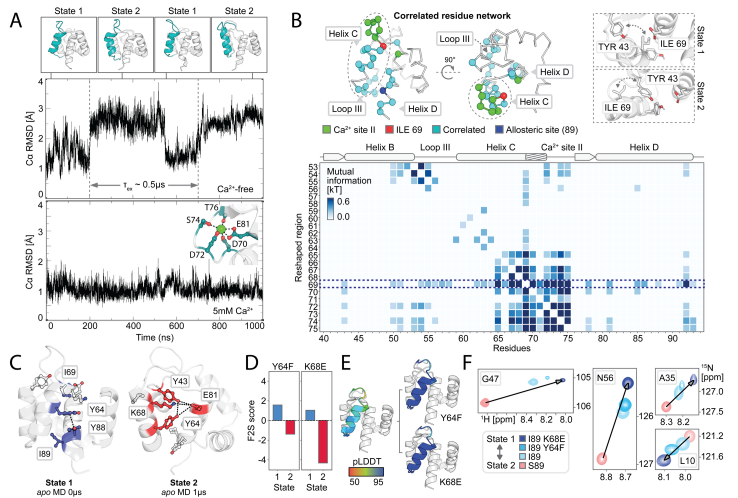
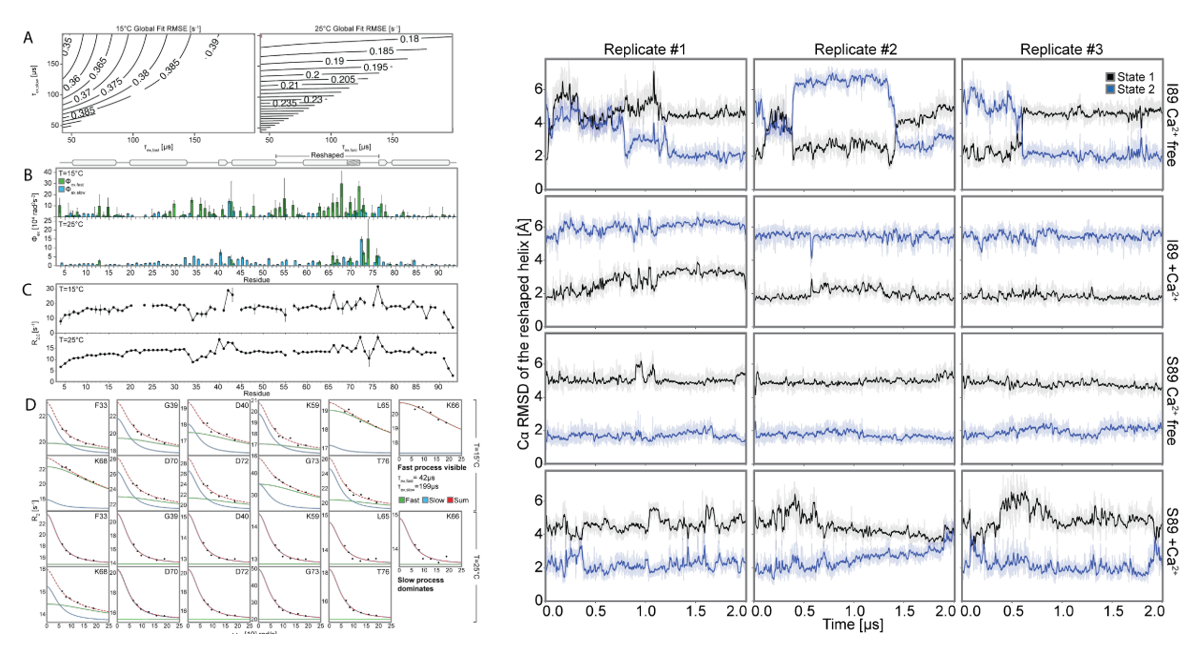
为了进一步探测设计的构象转换背后的原子级相互作用,研究者们对具有和不具有Ca2+的设计I89(有or无Ca2+)和S89(有or无Ca2+)进行了分子动力学(MD)模拟,分析构象切换。针对apoI89的MD轨迹,分析侧链扭转动力学的互信息,解析疏水网络;通过Frame2seq模型预测突变,结合AF2评估,再经NMR谱验证构象群体变化。最终发现:(1) I89无Ca2+时,两态(状态1/2)低微秒尺度切换(与R2ρ数据一致);加Ca2+后,Ca2+结合位点II,稳定状态1;(2) S89无论有无Ca2+,均保持状态2(符合AF2高置信度及实验数据)。并解释该机制:(1) 疏水网络连接Ca2+结合位点II、环III、螺旋D,89位通过立体/氢键差异耦合该网络;(2) 识别状态特异性网络:状态1中ILE69埋藏、TYR64/TYR88π-π堆积;状态2中ILE69暴露、TYR43参与氢键/静电作用。研究结果解释了观察到的变构调制的构象景观突变的关键位置89和验证预测,以进一步调整开关平衡。

总结
该研究建立双构象蛋白设计新策略:通过正构配体与变构突变协同调控构象互变,突破传统"域替换/刚性接触"设计局限,实现激酶/GPCR类互作新模式。结合深度学习(设计空间压缩、关键序列预测)与物理模拟,解析双态稳定残基网络;虽无法预测时变交换,但可处理态间复杂互作。成功生成类天然构象变化,首次实现"从头设计变构开关"及态丰度调控,证明其可构建正交开关与信号系统,为动态蛋白设计与机制解析提供普适工具。
