瘦素受体(Leptin receptor,LEPR),是一种跨膜蛋白,属于I类细胞因子受体超家族,其主要功能是介导瘦素发出的“饱腹信号”和“能量充足信号”,从而调控全身的能量稳态。通过下丘脑弓状核的POMC/AgRP神经元调节食欲,抑制摄食并增加能量消耗(如棕色脂肪产热、骨骼肌脂肪酸氧化);参与肝脏糖异生、脂肪合成及脂肪组织的自分泌调节。
LEPR的表达分布
LEPR异构体A在胎儿肝脏、造血组织和脉络丛中表达。在成人中,其在心脏、肝脏、小肠、前列腺和卵巢中表达量最高,在肺和肾脏中表达水平较低。异构体B在丘脑中高表达,也见于骨骼肌;在胃黏膜的胃底和胃窦上皮细胞中可检测到。异构体B和异构体A可在自然杀伤(NK)细胞中表达。
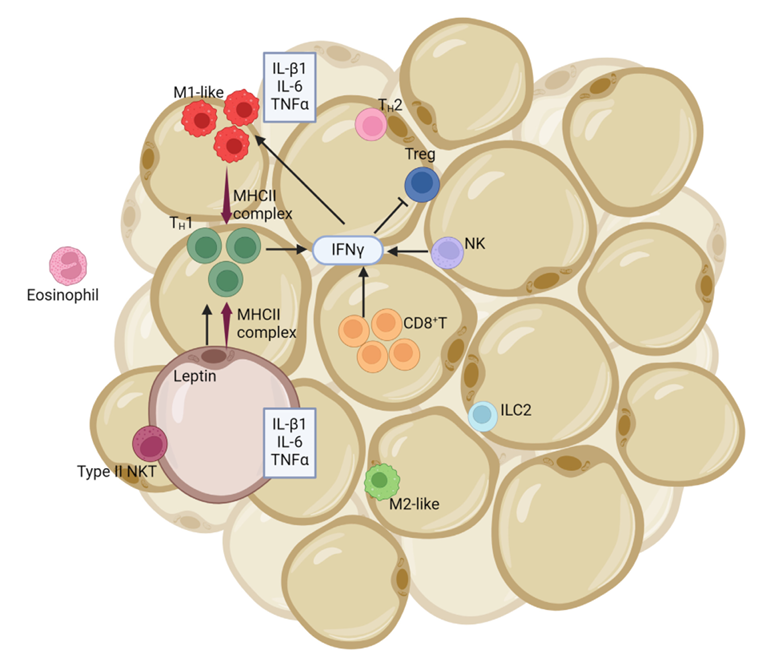
(数据来源:Abdulla A, et al.J Natl Cancer Cent. 2024)
LEPR的结构
LEPR是由LEPR基因编码的长度为1165 aa,分子量约132,4 kDa的Ⅰ型跨膜蛋白,由胞内区,跨膜区和胞外区三个部分组成,并通过选择性剪接生成多种异构体(如长型LEPR-b、短型LEPR-a/c/d/f、可溶型LEPR-e)。
胞外区(22-839 aa):a)细胞因子受体同源域2(CRH2):是瘦素结合的关键区域。它包含两个保守的二硫键,负责特异性识别和结合瘦素分子。b)免疫球蛋白样结构域(Ig-like Domain):位于CRH2结构域之前,可能参与稳定瘦素-受体复合物或与其他辅助蛋白的相互作用。c)两个纤维连接蛋白III型结构域(FnIII Domains):这是I类细胞因子受体的标志性结构,靠近细胞膜,对于受体二聚化(两个受体结合形成二聚体)和信号转导至关重要。
跨膜区(840-862 aa):由一个α螺旋组成,其主要功能是将受体锚定在细胞膜上,并将胞外区的构象变化传递到胞内区。
胞质区(863-1165 aa):a)这是信号转导的核心。LEPR的胞内域本身不具有酶活性,但它可以招募并激活下游的酪氨酸激酶。b)其长度和氨基酸序列是区分LEPR不同亚型(主要是长亚型LepRb和短亚型)的关键。长亚型LepRb拥有最长的胞内域,包含多个用于信号募集的保守基序,是发挥主要生理功能的亚型。
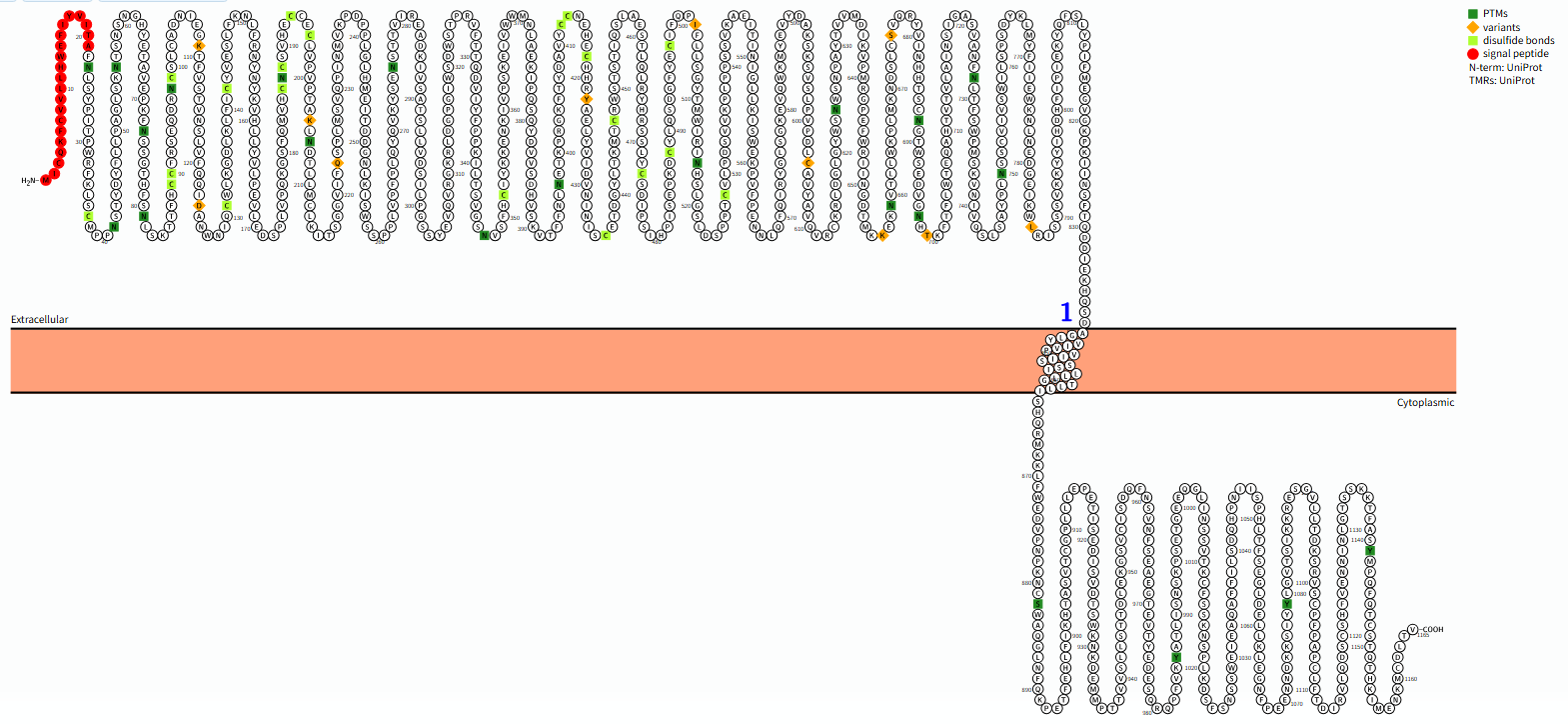
(数据来源:protter)
LEPR的信号通路
a)JAK-STAT通路:瘦素与受体的胞外域结合,导致受体形成二聚体受体二聚化后,其胞内域招募并激活与之结合的JAK2(Janus Kinase2)酪氨酸激酶,活化的JAK2使受体胞内域上的特定酪氨酸残基磷酸化,为下游信号蛋白提供docking位点。最重要的信号蛋白是STAT3(Signal Transducer and Activator of Transcription3)。
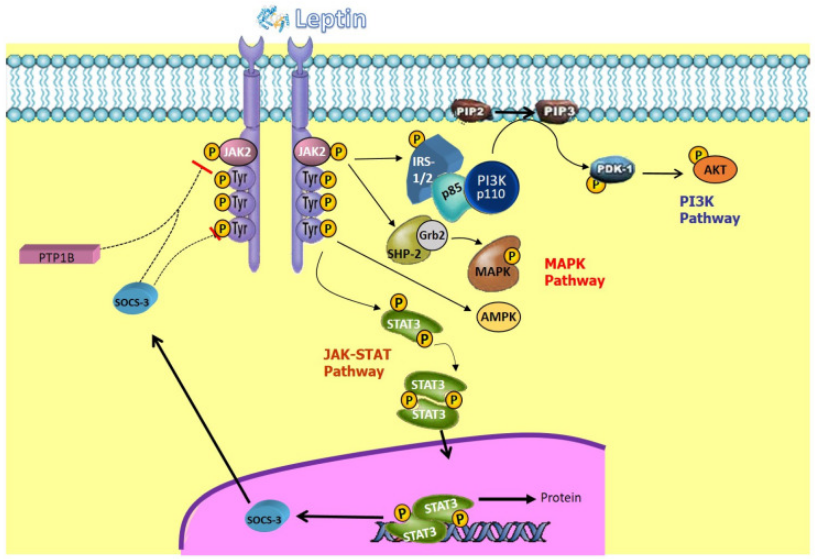
(数据来源:Vilariño-García T, et al.Int J Mol Sci. 2024)
b) PI3K-AKT通路:这条通路的激活更间接。一方面,JAK2可以磷酸化胰岛素受体底物(IRS)蛋白,使其招募并激活PI3K。另一方面,STAT3的基因转录产物也可能间接影响该通路。
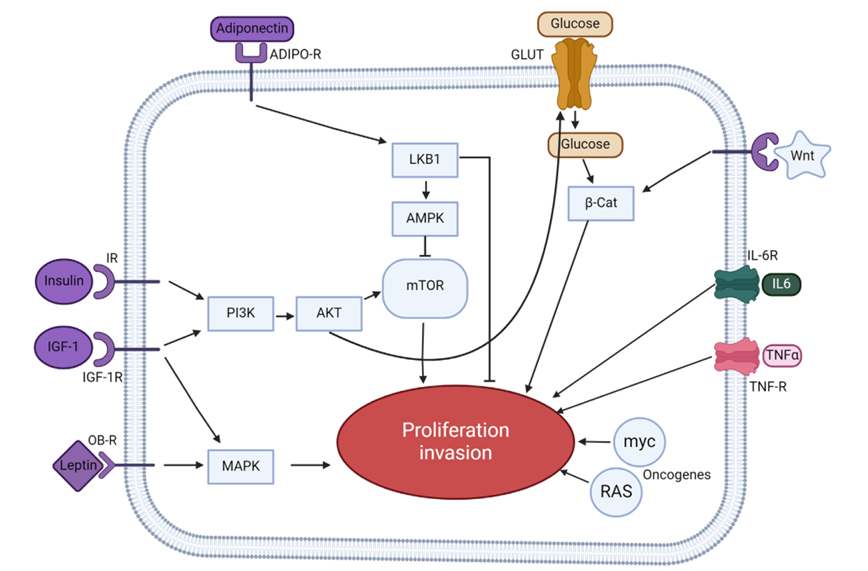
(数据来源:Abdulla A, et al.J Natl Cancer Cent. 2024)
LEPR与疾病
严重早发性肥胖(severe early-onset obesity):多见于先天性LEPR基因突变,导致受体功能完全或部分丧失。瘦素无法发出“饱腹”信号,大脑误认为身体处于饥饿状态。
心血管疾病(Cardiovascular Disease): 正常状态:循环瘦素水平适中,脂肪细胞形态正常,心脏健康。当出现脂肪营养不良(Lipodystrophy)时,出现脂肪细胞凋亡(Apoptosis)导致瘦素分泌不足(Insufficient Leptin),最终诱发心血管疾病。当出现肥胖(Obesity)时,脂肪细胞肥大(Hypertrophy),导致瘦素抵抗(Leptin Resistance,瘦素虽多但信号失效),最终同样会诱发心血管疾病。
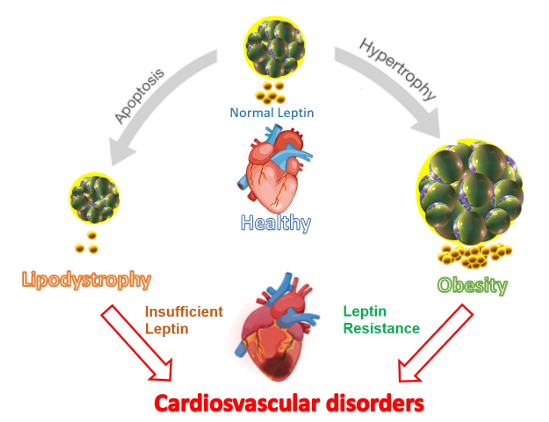
(数据来源:Vilariño-García T, et al.Int J Mol Sci. 2024)
瘦素/胰岛素抵抗(leptin/insulin resistance ):瘦素激活其受体(LepR)后,通过JAK-STAT3通路调控POMC/AGRP等食欲基因,并激活PI3K-Akt通路以抑制FoxO1。该通路与胰岛素受体(InsR)信号交叉串扰。发生瘦素抵抗时,LepR功能异常致使PI3K-Akt激活不足,一方面减弱对FoxO1的抑制,引起食欲失调和摄食增加;另一方面使AMPK对mTOR的抑制作用下降,导致mTOR通路过度活化,促进脂质合成与代谢紊乱。同时,瘦素信号障碍会进一步干扰胰岛素信号,形成“瘦素抵抗-胰岛素抵抗”恶性循环。
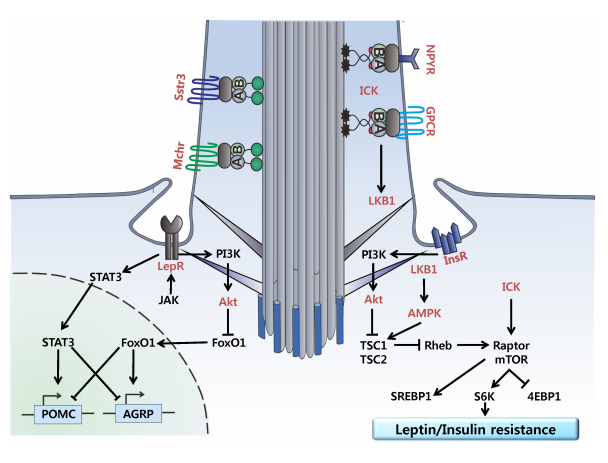
(数据来源:Lee H, et al. BMB Rep. 2015)
乳腺癌(Breast Cancer)领域:a)瘦素结合LEPR,经MAPK/STAT3通路,促进 CYP19A1 转录,增强芳香化酶活性,将雄激素转化为雌二醇(Estradiol);雌二醇入核结合ERα,激活癌相关基因。b)瘦素结合LEPR,经STK11-AMPK-CRTC2通路,上调 CYP19A1 ,同样驱动芳香化酶介导的雌二醇合成,反向支持乳腺癌进展。

(数据来源左:Jiménez-Cortegana C, et al. Biomolecules. 2021;右:Dutta D, et al. Indian J Endocrinol Metab. 2012)
LEPR的靶向治疗
Mibavademab(米瓦德单抗)是由Regeneron Pharmaceuticals(再生元制药公司)联合研发的一款靶向LEPR的单克隆抗体药物。其主要的作用机制是作为LEPR的激动剂,通过结合LEPR增强其活性,改善代谢异常,用于治疗先天性全身性脂肪营养不良和肥胖。于2024年12月16日批准3期临床试验。
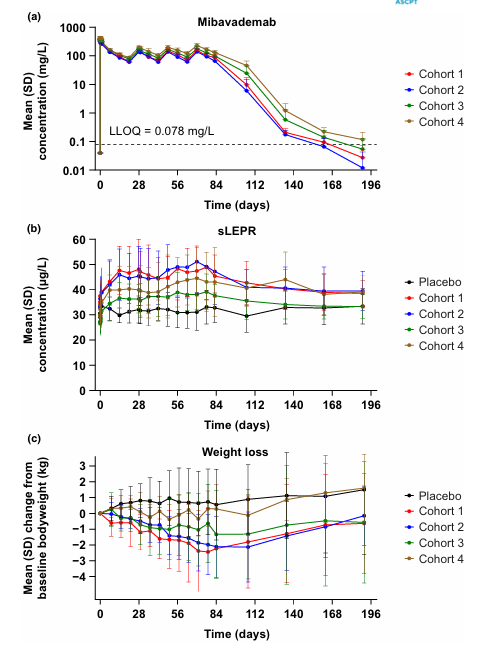
(数据来源:Gewitz A, et al. Clin Transl Sci. 2024)
Anti-LEPR/GP130 bispecific antibody是由Regeneron Pharmaceuticals研发的一款靶向LEPR和IL6RB的双特异性抗体药物。其主要的作用机制是作为LEPR的激动剂和IL6RB的调节剂,通过靶向LEPR和IL6RB(GP130)调节代谢与炎症通路,用于治疗肥胖和内分泌代谢疾病。目前处于临床前阶段。
Recombinant methionyl human Fc-leptin是由Amgen研发的一款靶向LEPR的Fc融合蛋白药物。其主要的作用机制作为LEPR的拮抗剂,用于治疗肥胖。目前临床阶段不明。
CV-08-01是由Cellivery Therapeutics研发的一款靶向LEPR的融合蛋白药物。其主要的作用机制是作为LEPR的拮抗剂,通过阻断LEPR信号抑制肿瘤生长或代谢异常,用于治疗肝细胞癌和肥胖。目前处于研发终止阶段。
我们收集整理一批LEPR相关抗体序列信息。文档可关注公众号,号内回复“ LEPR ”下载。
