催乳素受体(PRLR)通过抑制SRC激酶的激活和刺激AKT,它通过抑制精子的成熟来作为一种促存活因子作用于精子。PRL/PRLR信号会促进乳腺癌的发生和发展。PRLR的表达分布
PRLR主要表达在子宫内膜间质细胞,乳腺腺体细胞,合体滋养层细胞,前列腺基底细胞,近端肾小管细胞中。
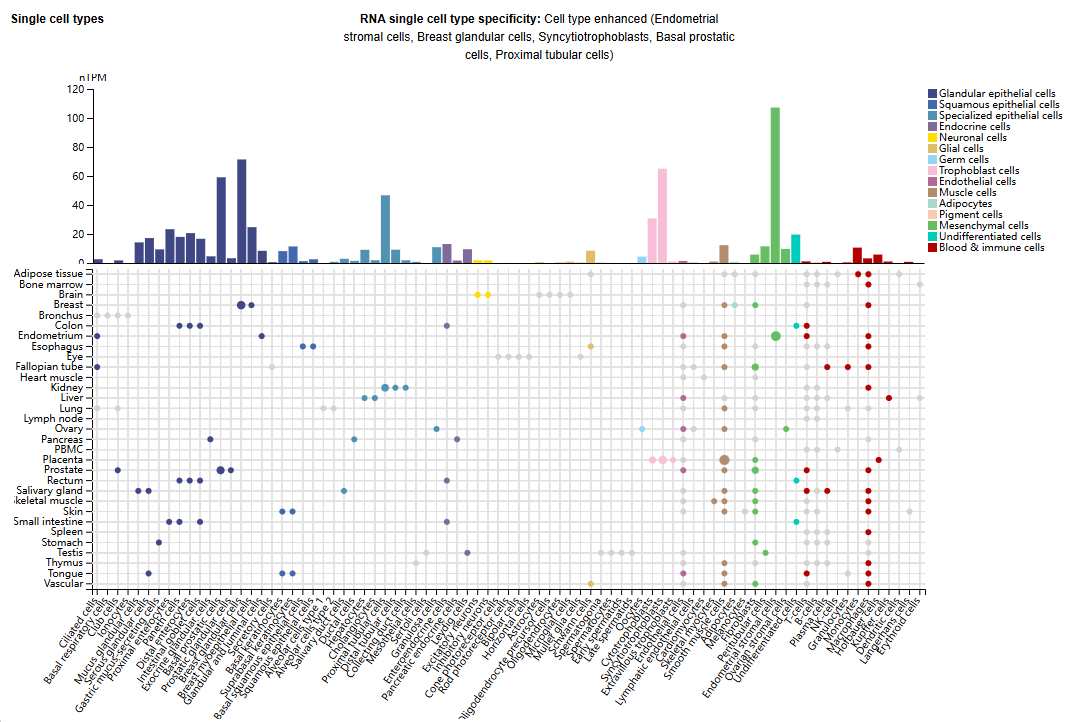
(数据来源 unprot)
PRLR的结构
PRLR是一种I型膜蛋白,由622个氨基酸组成,有三个主要结构域:细胞外、跨膜和细胞内。
胞外结构域:两个纤维连接蛋白III型结构域(FnIII domains)D1和D2组成,这是I型细胞因子受体家族的标志性特征。D2中的WS模式在配体结合激活PRLR期间作为分子开关。催乳素与受体的结合界面主要涉及D2 domain,以及连接D1和D2的铰链区。
跨膜结构域:PRLR具有单通道跨膜链,受体链不具有激酶活性。受体链依赖于相关的激酶来转导基于磷酸化的信号级联。
胞内结构域:由Box1和Box2 两个亚结构域组成,Box1是一个富含脯氨酸的保守序列(Pro-X-X-Pro-X-Pro),对于与Jak2激酶的结合和激活至关重要。Box 2是一个疏水性的保守区域,同样有助于Jak2的招募和稳定。长型受体含有完整的Box 2,而短型受体则缺失或部分缺失。
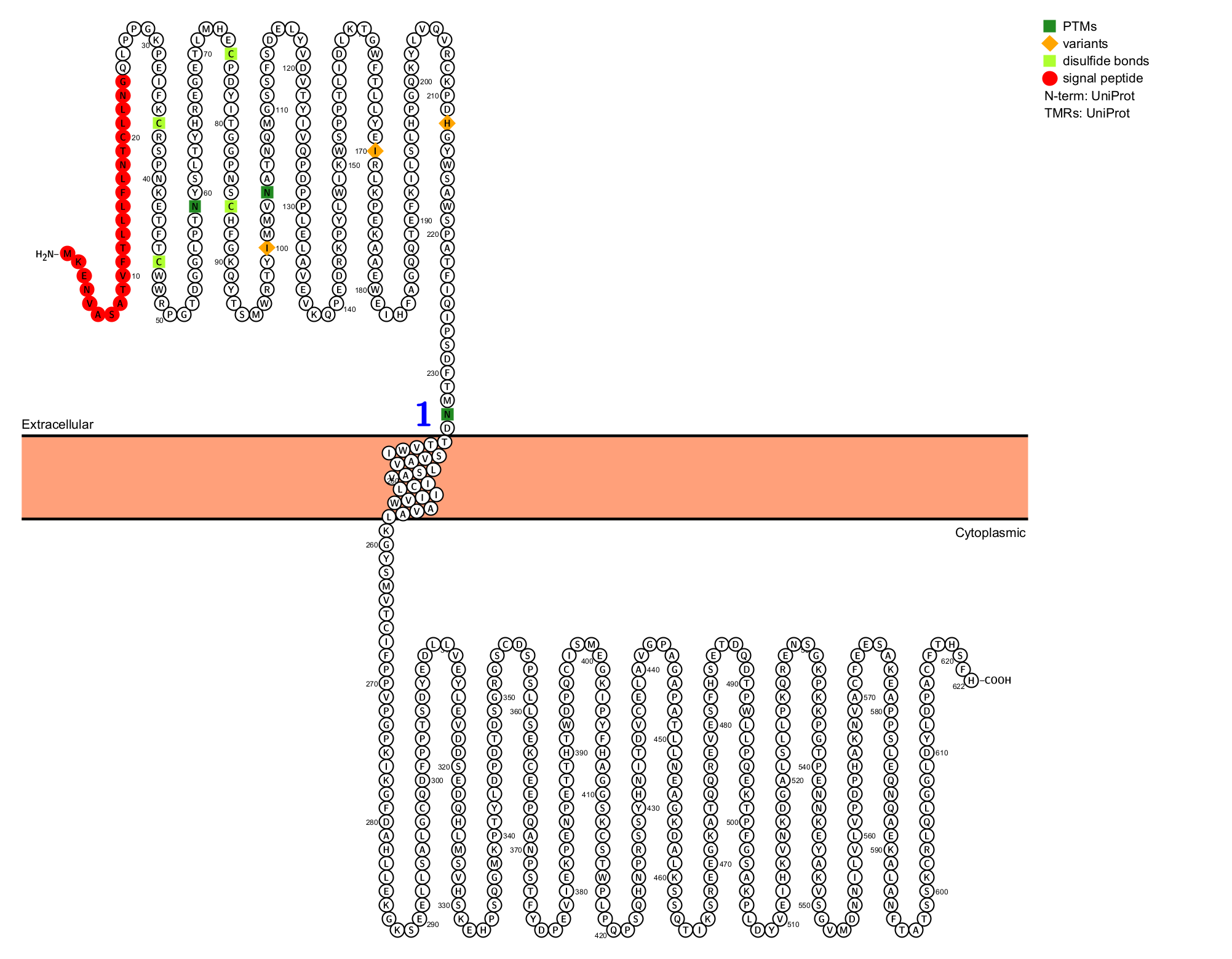
(数据来源 uniprot)
PRLR的信号通路和调控
PRL与PRLR二聚体结合,导致构象变化,导致JAK/STAT通路、MAPK和SRC激酶的激活。这些信号通路涉及哺乳、免疫反应、细胞骨架重塑和细胞生长、增殖及存活。

(数据来源 Kavarthapu R, et al. Front Endocrinol . 2022)
PRL/PRLR诱导的信号级联促进肿瘤细胞增殖、存活、侵袭转移,诱导治疗抵抗(尤其是对他莫昔芬的耐药)。乳腺肿瘤周围基质微环境释放的EGF激活信号级联,在乳腺肿瘤细胞分泌的PRL激活时与PRLR信号级联重叠。PRL 通过JAK2刺激HER2 和EGFR信号通路。EGF/EGFR还通过s-SRC间接激活STAT5信号传导。受体之间的这种串扰会增加乳腺肿瘤的进展和内分泌抵抗。
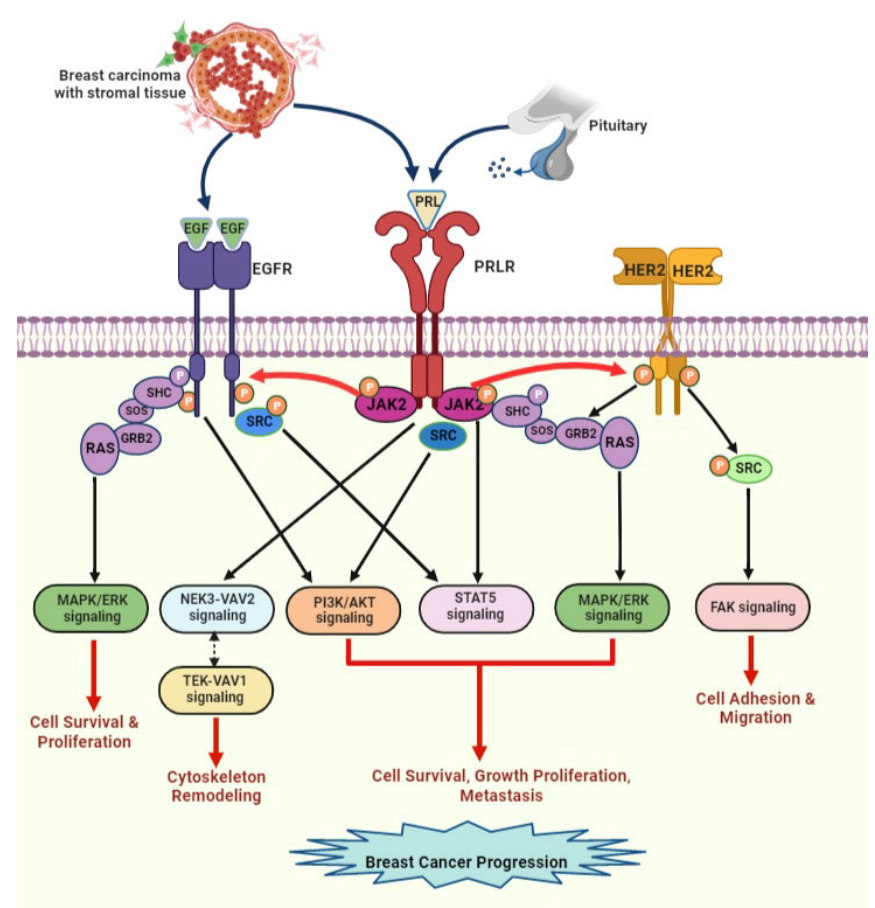
(数据来源 Kavarthapu R, et al. Front Endocrinol . 2022)
PRLR的靶向治疗
Rolinsatamab是一种艾伯维开发的靶向PRLR的单克隆抗体用于治疗实体瘤,在一项1期、剂量递增研究中(NCT03145909),ABBV-176与显著毒性相关。尽管细胞减少症通常是剂量限制因素,但积液和水肿也很常见,且出现较晚,提示累积毒性。尽管数据来自肿瘤PRLR表达不同的一小部分患者,但未观察到任何缓解。在19名患者用药后,该研究终止。
BAY-1158061(也称为HMI-115)是一款靶向PRLR的单克隆抗体。目前由和其瑞医药主导其全球临床开发。它最初由拜耳(Bayer)研发。其拥有全球权益的单克隆抗体一类新药HMI-115已被中国国家药品监督管理局(NMPA)药品评审中心(CDE)纳入突破性治疗药物品种名单(BTD),拟定用于治疗子宫内膜异位症相关的中重度疼痛。HMI-115正在进行针对子宫内膜异位症和雄激素脱发两个适应症的全球临床二期试验(CDE临床试验登记号:CXSL2200442)。在中期分析包括的前102名患者中,HMI-115显示对于子宫内膜异位症相关疼痛有统计学意义的改善,HMI-115显示了良好的安全性,大多数患者报告月经正常,未报告典型的围绝经期症状,骨密度和重要性激素水平没有显著变化。

(数据来源 hopemedinc官网)
我们收集整理一批PRLR相关抗体序列信息。文档可关注公众号,号内回复“ PRLR ”下载。
