溶质载体家族1成员5(Solute Carrier Family 1 Member 5,SLC1A5/ASCT2),是一种跨膜蛋白,其主要功能是作为一种钠离子依赖性的中性氨基酸转运蛋白,在人体内由 SLC1A5 基因编码。它主要负责细胞对中小型中性氨基酸的摄取,尤其对谷氨酰胺(Glutamine)有高度亲和性。
SLC1A5的表达分布
SLC1A5特异性表达于在肝脏、肾脏、小肠、大脑(尤其在血脑屏障的内皮细胞和星形胶质细胞中)、睾丸、胎盘和激活的淋巴细胞中高表达。在这些组织中,其主要功能是参与器官间的氨基酸分配、吸收和再循环。肿瘤组织中的表达:在多种实体瘤中过度表达,其表达水平常与肿瘤的恶性程度、分期和不良预后相关。
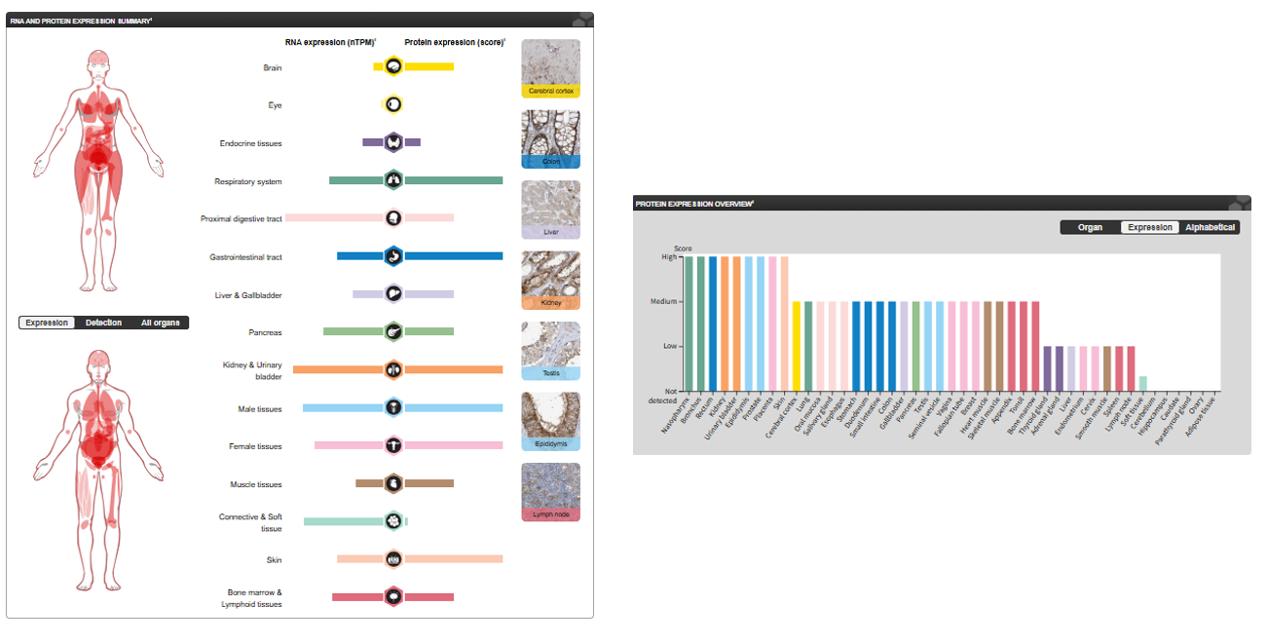
(数据来源:proteinatlas)
SLC1A5的结构
SLC1A5是由SLC1A5基因编码的长度为258 aa,分子量约28 kDa的Ⅲ型跨膜蛋白,由胞内区,跨膜区和胞外区三个部分组成。
运输域(Transport domain):负责底物(如谷氨酰胺)的结合与构象变化,关键的HP2 loop(细胞内loop)在底物识别时发生构象重排,直接参与底物结合口袋的形成。
支架域(Scaffold domain):通过ECL2a loop(细胞外loop2a)与运输域连接,为运输域的刚性移动提供结构支撑,确保转运循环中域间的协调运动。
跨膜区(69-86 aa;107-131 aa;143-169 aa):由三个α螺旋组成,其主要功能是将受体锚定在细胞膜上,并将胞外区的构象变化传递到胞内区。
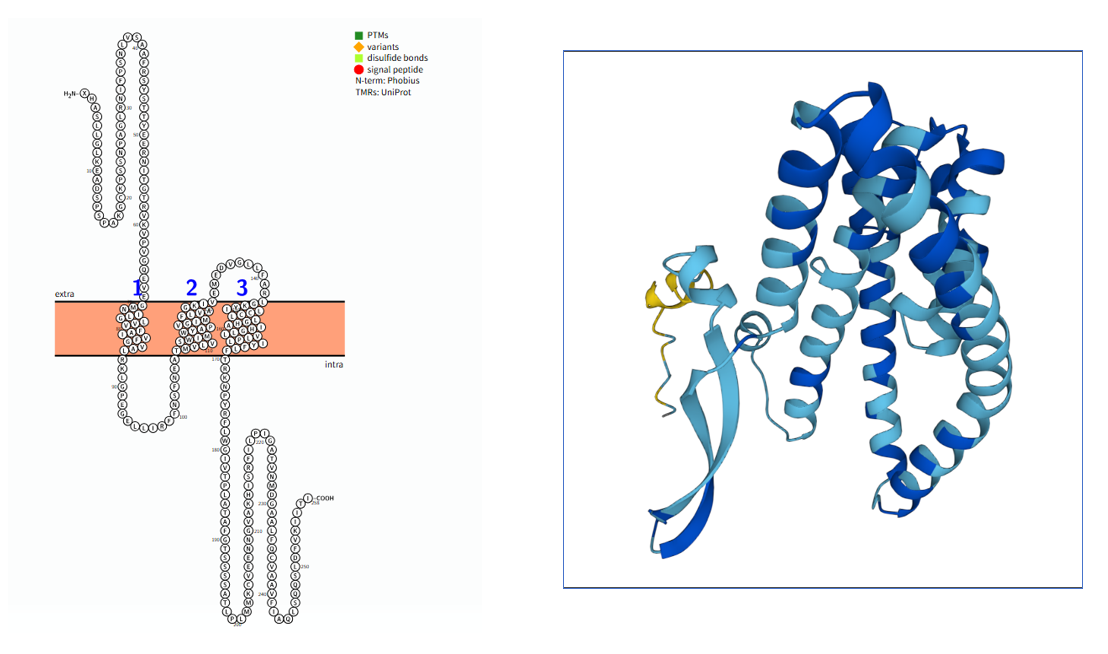
(数据来源:protter)
SLC1A5的信号通路
mTORC1(雷帕霉素靶蛋白复合体1)是细胞感受营养、能量和生长因子状态,并调控细胞合成代谢(如蛋白质合成、脂质合成)和细胞生长的核心信号枢纽。氨基酸是激活mTORC1的必要信号。
a)mTORC1激活通路:SLC1A5介导谷氨酰胺(Gln)摄取后,Gln经代谢生成α-酮戊二酸(α-KG)。通过Rag GTPases 激活 mTORC1,进而促进下游靶蛋白(如S6K1、4EBP1)磷酸化,推动细胞增殖与蛋白质合成。该通路在肿瘤细胞中常过度激活,例如胰腺癌中IGF2BP2通过m⁶A修饰稳定SLC1A5 mRNA,增强谷氨酰胺摄取以激活mTORC1。
(数据来源:Chen C et al. Front Pharmacol. 2022)
b)c-Myc转录调控:原癌基因c-Myc是SLC1A5的一个关键转录因子。c-Myc会直接结合在SLC1A5基因的启动子区域,显著上调其转录和蛋白表达。这使得癌细胞能够获得更多的谷氨酰胺,满足其疯狂增殖的需求。
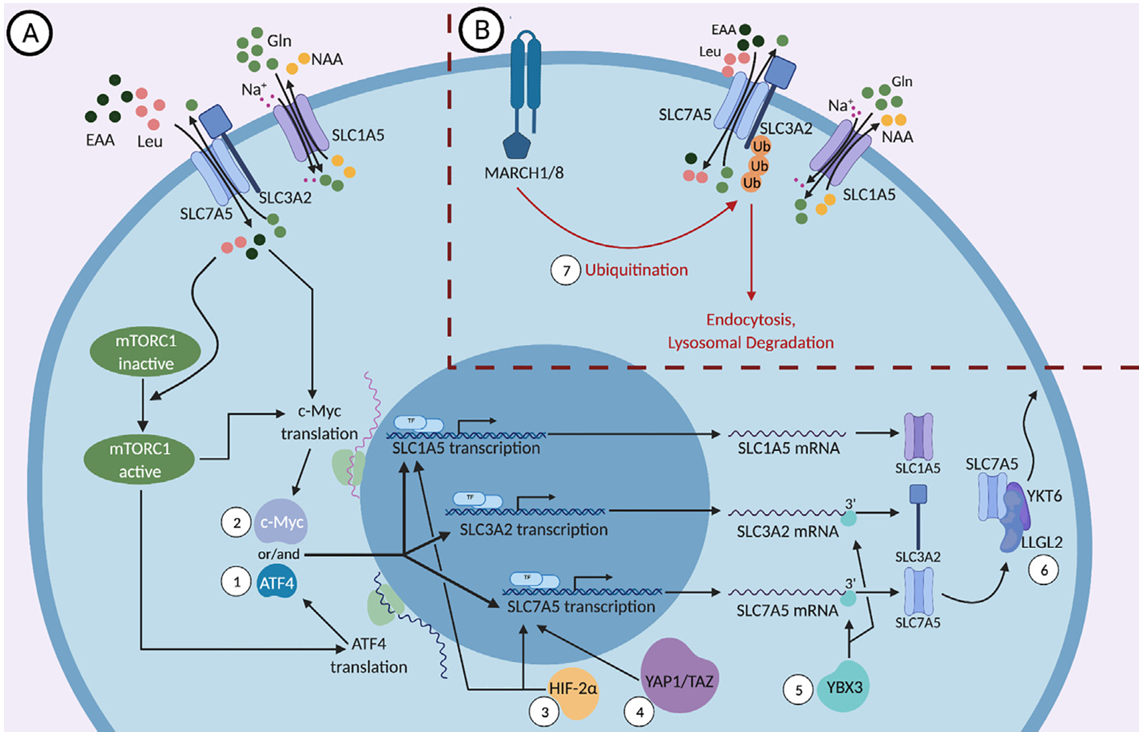
(数据来源:Nachef M et al. Front Immunol. 2021)
SLC1A5与疾病
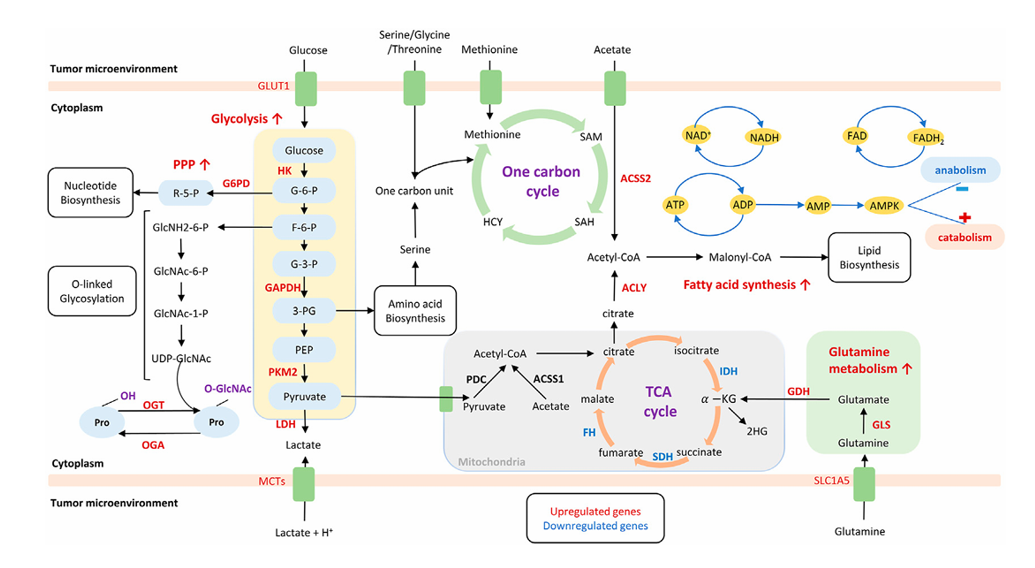
癌细胞代谢中铁死亡:一种由脂质过氧化引起的非凋亡、铁依赖性细胞死亡形式,称为铁死亡。细胞膜转运系统(如SystemXc⁻、GLUT1、TFRC等)通过介导胱氨酸、葡萄糖和铁等物质的摄取,为谷胱甘肽(GSH)合成、能量代谢和铁稳态提供基础。代谢通路如PPP产生NADPH支持抗氧化防御,O-GlcNAc修饰调控多种关键蛋白。铁池水平受线粒体自噬和铁蛋白自噬等过程影响。这些系统共同调控脂质过氧化与GSH–ROS平衡,从而整合决定铁死亡的敏感性。
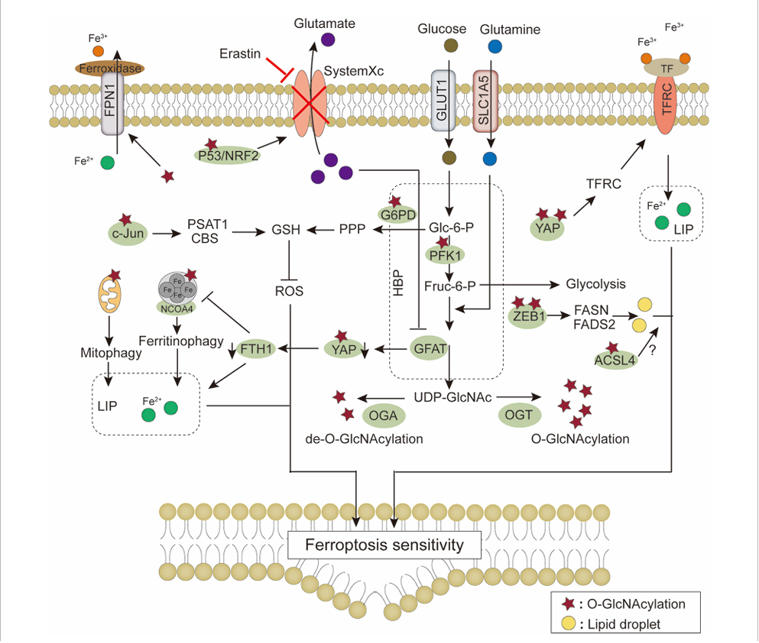
(数据来源:Zhang H et al. Front Mol Biosci. 2023)
心血管疾病(cardiovascular disease(CVD))领域:SLC1A5是细胞膜上的转运蛋白,主要作用是参与谷氨酰胺的摄取,并与SystemXc(介导谷氨酸/半胱氨酸交换的系统)协同,影响细胞内谷胱甘肽(GSH)的合成(GSH是关键抗氧化分子,可清除活性氧ROS)。通过调控GSH水平和ROS平衡,SLC1A5最终影响铁死亡(ferroptosis)的敏感性(铁死亡与脂质过氧化、ROS积累密切相关,GSH不足会增强铁死亡易感性)。
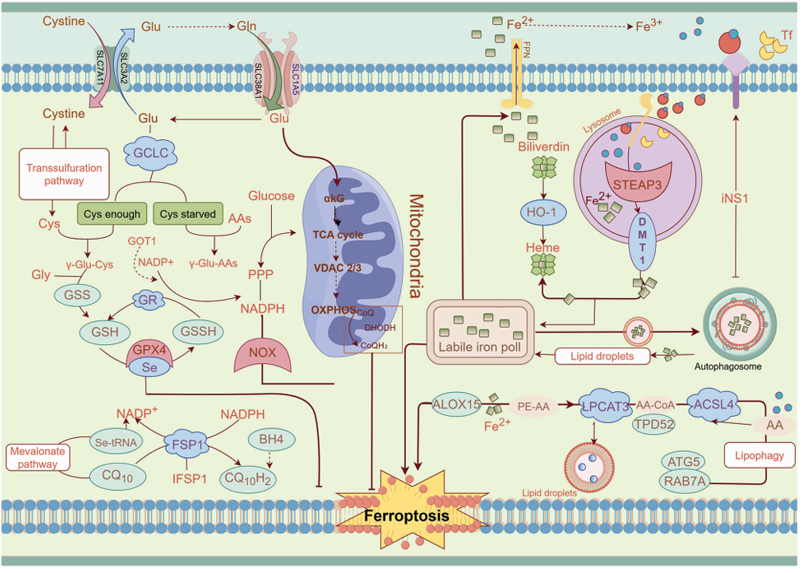
(数据来源:Qin S et al. Int J Mol Med. 2025)
人软骨肉瘤细胞中:双调蛋白(Amphiregulin,AR)通过激活MEK–ERK信号通路,磷酸化并活化转录因子Nrf2,进而促进包括SLC1A5在内的多个靶基因表达。SLC1A5介导的谷氨酰胺摄取增加,经GLS分解为谷氨酸后进入线粒体,增强TCA循环代谢流,最终大量生成NADPH。该分子可有效清除顺铂所诱导的活性氧(ROS),减轻氧化损伤,从而显著提升细胞抗氧化能力,形成对顺铂的耐药性。
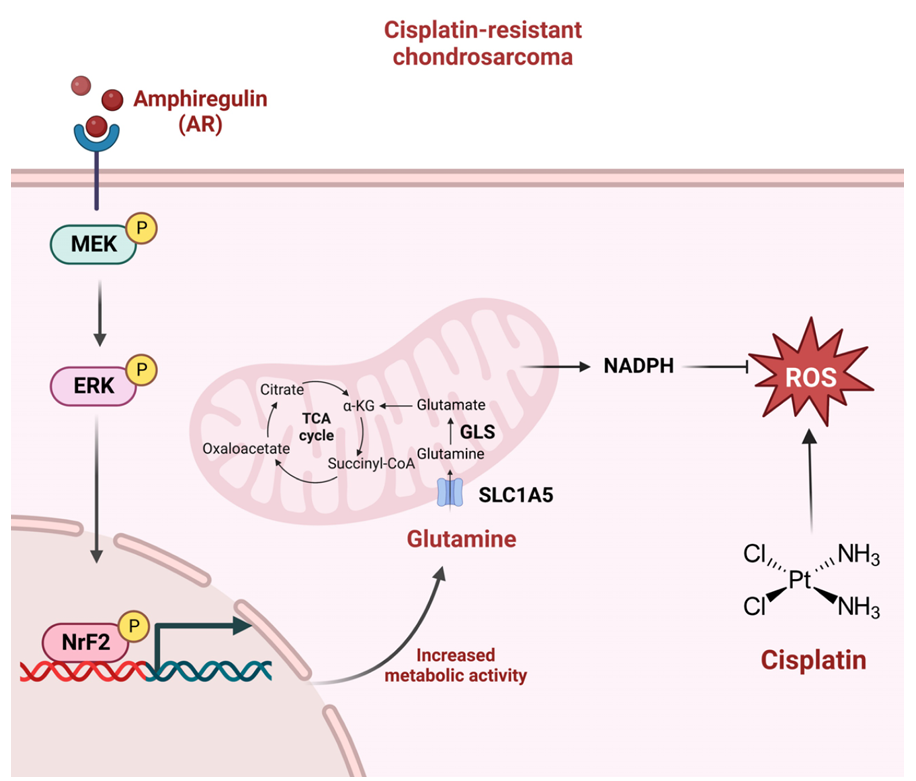
(数据来源:Wu YY et al. Int J Biol Sci. 2023)
免疫原性细胞死亡(immunogenic cell death,ICD)领域:肿瘤细胞通过膜转运蛋白(如SLC1A5/SLC7A5和葡萄糖转运蛋白)摄取营养,经糖酵解、磷酸戊糖途径、TCA循环及氧化磷酸化高效获取能量和NADPH,并借助谷胱甘肽等系统维持氧化还原平衡,促进自身存活。此外,肿瘤代谢通过不同途径调控免疫微环境:铁死亡释放的DAMPs可促进树突状细胞成熟并激活T细胞;而乳酸积累和IDO1介导的色氨酸-犬尿氨酸代谢则抑制T细胞功能,形成免疫抑制环境,从而共同影响抗肿瘤免疫应答。
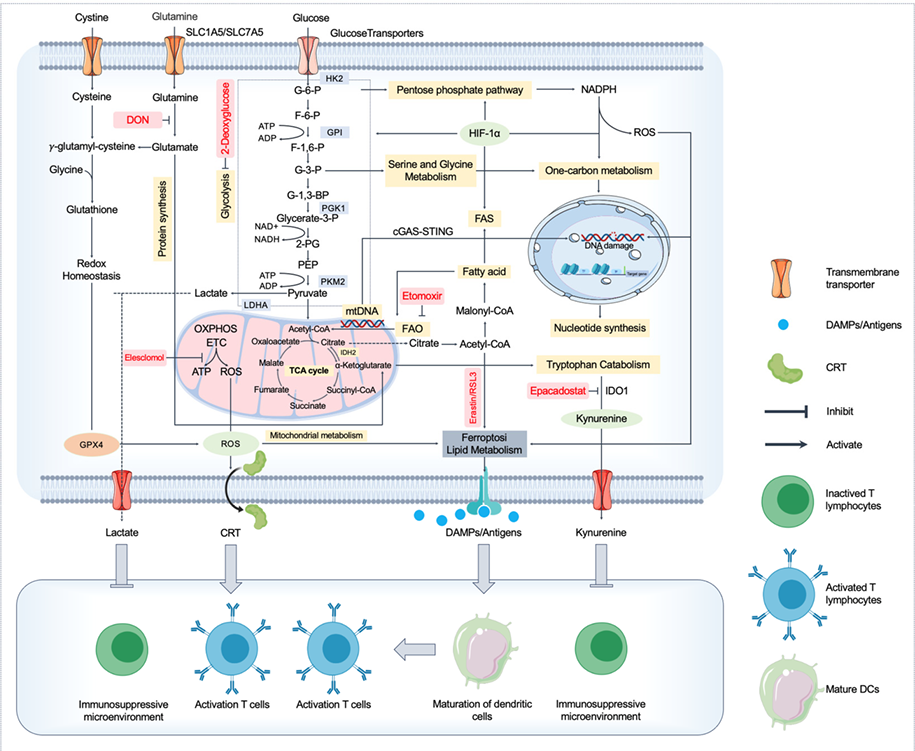
(数据来源:Jiang J et al. Biomedicines. 2025)
SLC1A5的靶向治疗
通过基因工程让CAR-NK/T细胞(嵌合抗原受体修饰的自然杀伤细胞/T细胞)过表达SLC1A5等分子后,能增强CAR-NK/T细胞对肿瘤细胞的识别能力,同时提升CAR-NK/T细胞的功能、存活能力以及在体内的持久作用,助力其更有效地对抗肿瘤细胞。
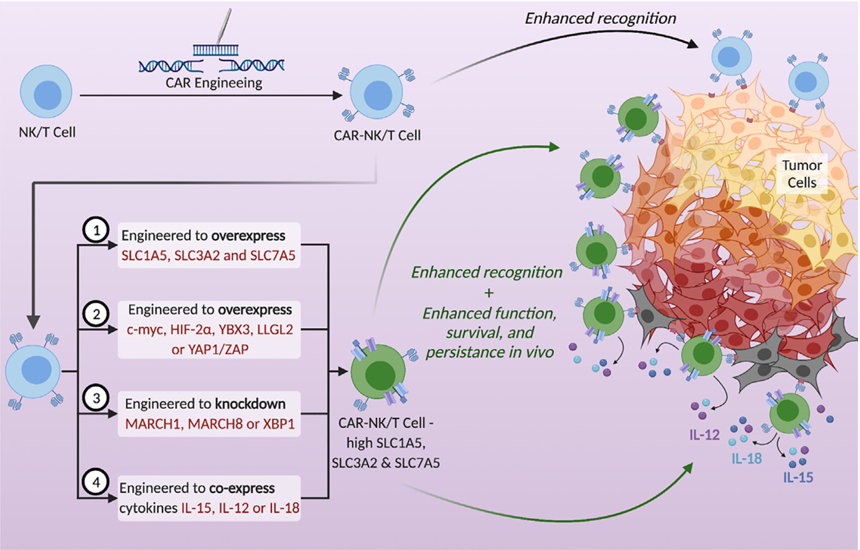
(数据来源:Dhar C et al. Front Cell Neurosci. 2023)
Idactamab是由AstraZeneca PLC研发的一款靶向SLC1A5和DNA的ADC药物。其主要的作用机制是作为SLC1A5的抑制剂,抗体部分靶向ASCT2(SLC1A5),抑制其功能,从而阻断谷氨酰胺依赖性代谢通路,抑制肿瘤生长;偶联的DNA抑制剂可直接损伤肿瘤细胞DNA,增强抗肿瘤效果。用于治疗Acute Myeloid Leukemia(急性髓性白血病)和Advanced Malignant Solid Neoplasm(晚期恶性实体瘤)及Colorectal Cancer(结直肠癌)。于2017年3月29日批准1期临床试验,但目前没有进展。
HuB14-VA-PL2202是由ADC Therapeutics SA研发的一款靶向SLC1A5和TopoⅠ的ADC药物。其主要的作用机制是作为ASCT2抑制剂和TOP1抑制剂。ASCT2抑制剂:靶向肿瘤细胞表面的氨基酸转运蛋白ASCT2(SLC1A5),通过阻断谷氨酰胺等关键营养物质的摄取,抑制肿瘤细胞的代谢重编程和增殖。TOP1抑制剂:通过释放拓扑异构酶I(TOP1)抑制剂,干扰DNA复制与修复,诱导肿瘤细胞DNA损伤及凋亡。该药物的设计结合了靶向代谢通路(ASCT2)与DNA损伤修复(TOP1)的双重抗肿瘤策略,主要用于治疗实体瘤和血液恶性肿瘤(如急性髓系白血病、淋巴瘤)。目前处于临床前阶段。
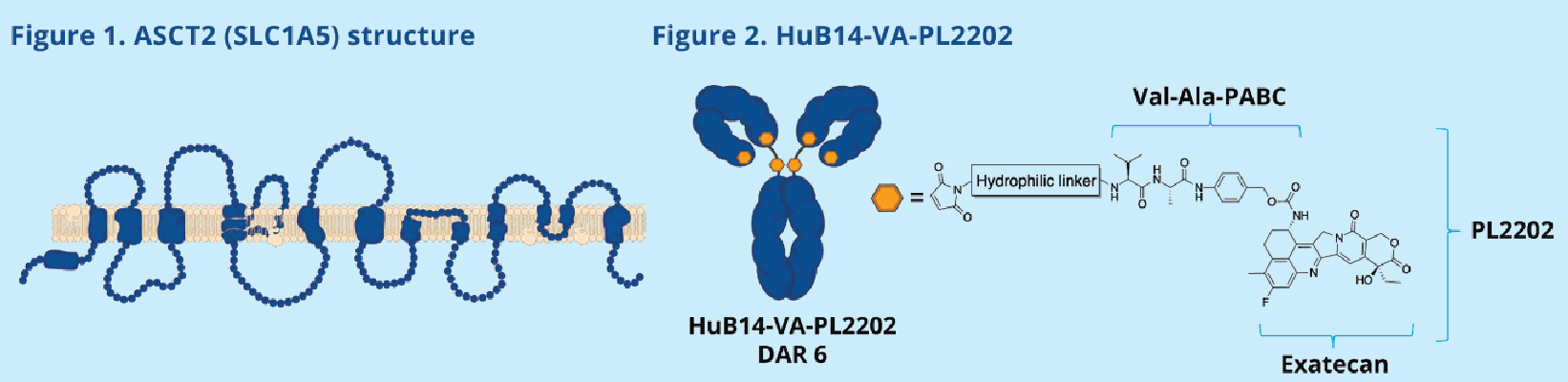
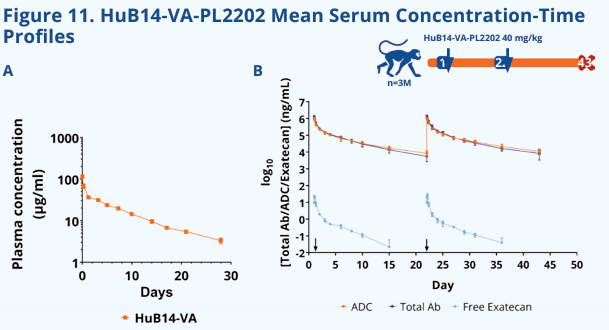
(数据来源:Danilo Cucchi et al. Cancer Research . 2025)
我们收集整理一批SLC1A5相关抗体序列信息。文档可关注公众号,号内回复“SLC1A5”下载。
