基质金属蛋白酶-9(MMP9)可以特异性降解IV型胶原,在细胞外基质的局部蛋白水解和白细胞迁移中起重要作用。由于其蛋白水解活性,通过调节癌细胞的迁移、上皮间质转化和存活、诱导免疫反应、血管生成和肿瘤微环境的形成,在肿瘤发生中发挥关键作用。MMP9的表达分布
MMP9主要表达在朗格汉斯细胞、巨噬细胞、霍夫鲍尔细胞中,在正常生理状态下,中性粒细胞是MMP9的主要来源,在机体的天然免疫反应中发挥重要作用。
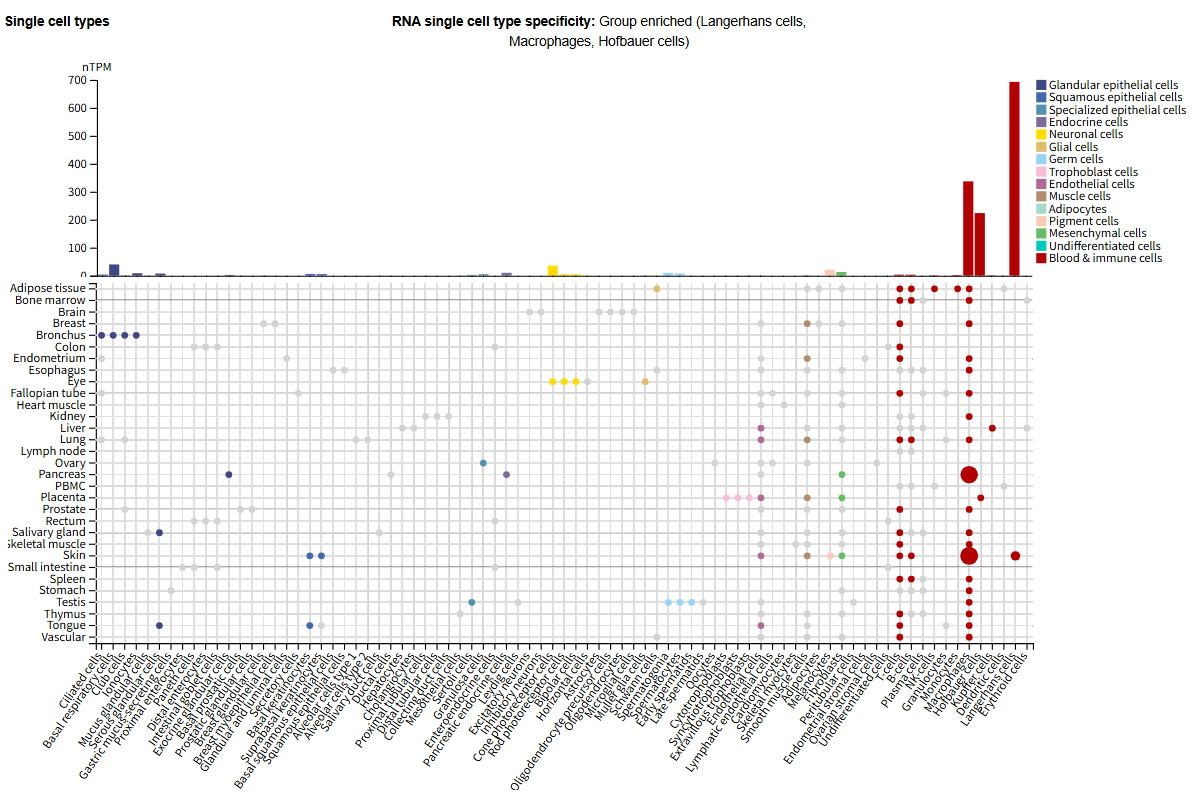

(数据来源 uniprot)
MMP9的结构
MMP9是一种分泌型蛋白,作为一种前酶被合成,然后以一种前MMP9-9酶的形式转移到细胞外环境。活化的MMP-9是由蛋白酶介导的MMP-9前体酶的裂解产生的。MMP-3是通过去除N端前肽区从而激活MMP-9的蛋白酶的一个例子。N端前肽的去除显著破坏了MMP的潜伏性。

(数据来源 Wang Y, et al. Biomed Pharmacother. 2024)
MMP-9基因位于染色体20q13.12上,包含13个外显子和12个内含子。该蛋白由以下结构域组成:信号肽域、前肽区、催化域、血红素结合蛋白样域和铰链区。
信号肽(Signal Peptide):在蛋白质合成时引导其进入内质网,随后被切除,不存在于成熟蛋白质中。
前肽域(Propeptide Domain):包含一个高度保守的“半胱氨酸开关”序列(PRCGVPDV)。这个域的作用是维持酶的非活性状态(酶原)。其中的半胱氨酸残基与催化锌离子配位结合,阻止底物进入活性中心。当该域被外界蛋白酶(如胰蛋白酶、纤溶酶)或通过化学修饰(如有机汞试剂)破坏后,MMP9就会被激活。
催化域(Catalytic Domain):包含MMP家族高度保守的锌离子结合位点(HEXXHXXGXXH motif),这是催化活性的核心。还有一个结构性的锌离子和钙离子,用于稳定催化域的三维结构。负责底物蛋白质的水解切割。
铰链区(Hinge Region / Linker Peptide):一段柔性的肽链,连接催化域和hemopexin域。允许两个域之间发生相对运动,对于识别某些大分子底物和特异性非常重要。
血红素结合蛋白样域(PEX Domain):一个由四个blades组成的β-螺旋桨状结构。这个域不直接参与催化,但可识别特异性底物(如天然型IV型胶原)。与组织抑制剂TIMPs结合(尤其是TIMP-1)。与细胞表面受体(如CD44)相互作用,介导细胞定位和功能。
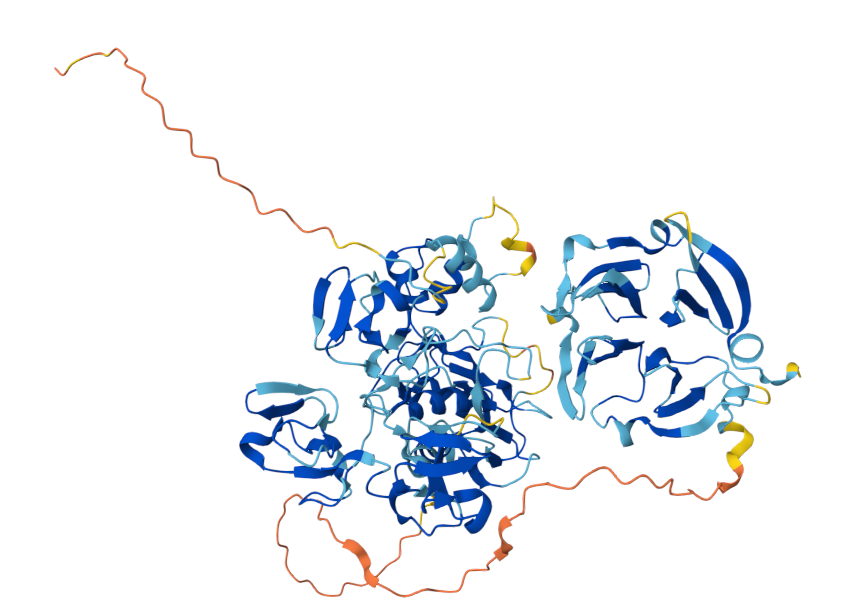
(数据来源 Alphafold)
MMP9的信号转导
MMP9的表达受到多种转录因子的调控,如激活蛋白1(AP-1)、核因子-κB(NF-κB)、特异性蛋白1(SP-1)等。这些转录因子可结合到MMP9基因启动子区域,启动转录过程,促进其表达。在炎症反应中,NF-κB被激活后可诱导MMP9的表达,从而参与炎症相关的组织重塑和细胞迁移。MMP9通过降解细胞外基质成分,释放出多种生物活性分子,如生长因子、细胞因子和趋化因子等,这些分子能够激活下游的信号通路,如MAPK/ERK、PI3K/AKT、FAK等,进而调节细胞的增殖、迁移、侵袭和存活等生物学行为。

(数据来源 Wang Y, et al. Biomed Pharmacother. 2024)
MMP9的靶向治疗
抗癌治疗的一个有吸引力的靶点。然而,一方面,MMP9的表达、合成和激活调节机制非常复杂,决定了这种酶的特异性、通常相互矛盾的作用,另一方面与MMP家族其他成员的高度同源性,使得开发有效和安全的MMP9抑制剂作为抗癌药物极其困难。
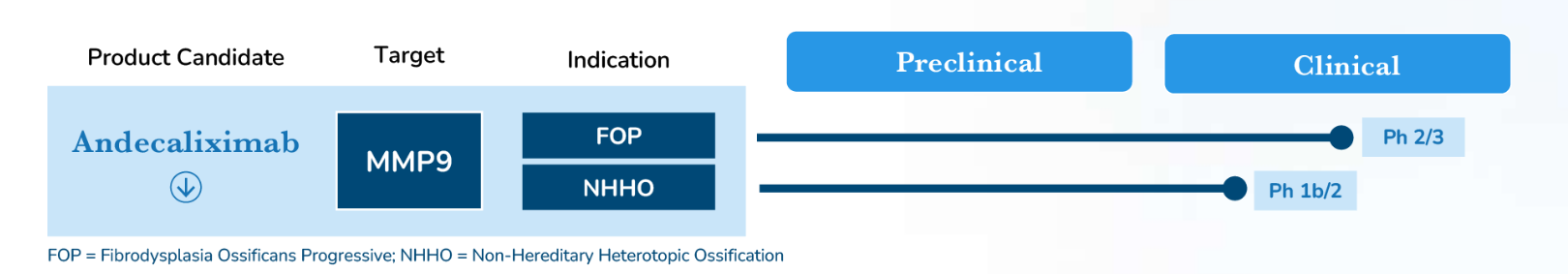
Andecaliximab是一种靶向MMP9的IgG4单克隆抗体,用于治疗进行性纤维性骨化症(FOP)和非遗传性异位骨化(NHHO),他们目前处于临床研究阶段。
在FOP中,MMP9是一种关键酶,它会在炎症组织中释放Activin-A的长形式。Activin-A 随后会与突变型ALK2受体结合,导致HO形成。在小鼠FOP模型中的研究表明,阻断MMP9的活性可以显著抑制HO的形成。Andecaliximab是MMP9的强效和特异性抑制剂。
在NHHO中,MMP9在创伤和炎症部位高度表达,是局部组织中释放骨形态发生蛋白(BMP)配体的关键酶。BMP配体(例如BMP 2、4、6)随后会与野生型ALK2受体结合,导致HO形成。āshibio在创伤诱导性HO的小鼠模型中进行的研究表明,MMP9抑制会导致HO显著减少。
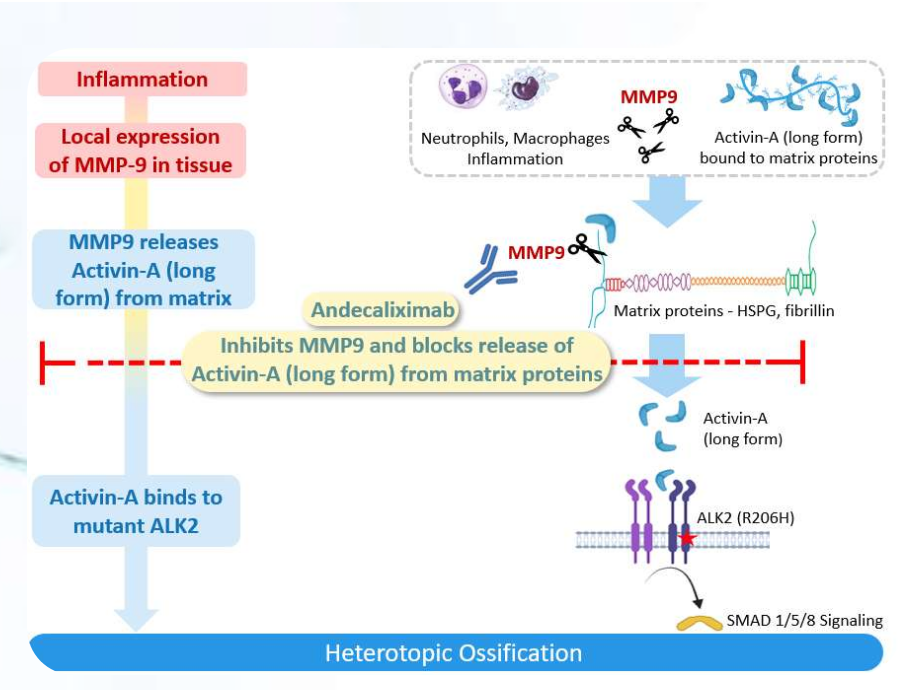
(数据来源 ashibio官网)
我们收集整理一批MMP9相关抗体序列信息。文档可关注公众号,号内回复“ MMP9”下载。
