前言
IgA在肠粘膜中介导微生物稳态。在肠道内通过T细胞非依赖性和T细胞依赖性途径产生微生物反应性IgA,在预防和促进细菌定植以及影响细菌基因表达中发挥作用,从而对微生物群提供精细的控制。IgA-微生物群的相互作用在个体和种群之间存在高度的多样性,然而驱动这种多样性的因素仍然不甚明了。
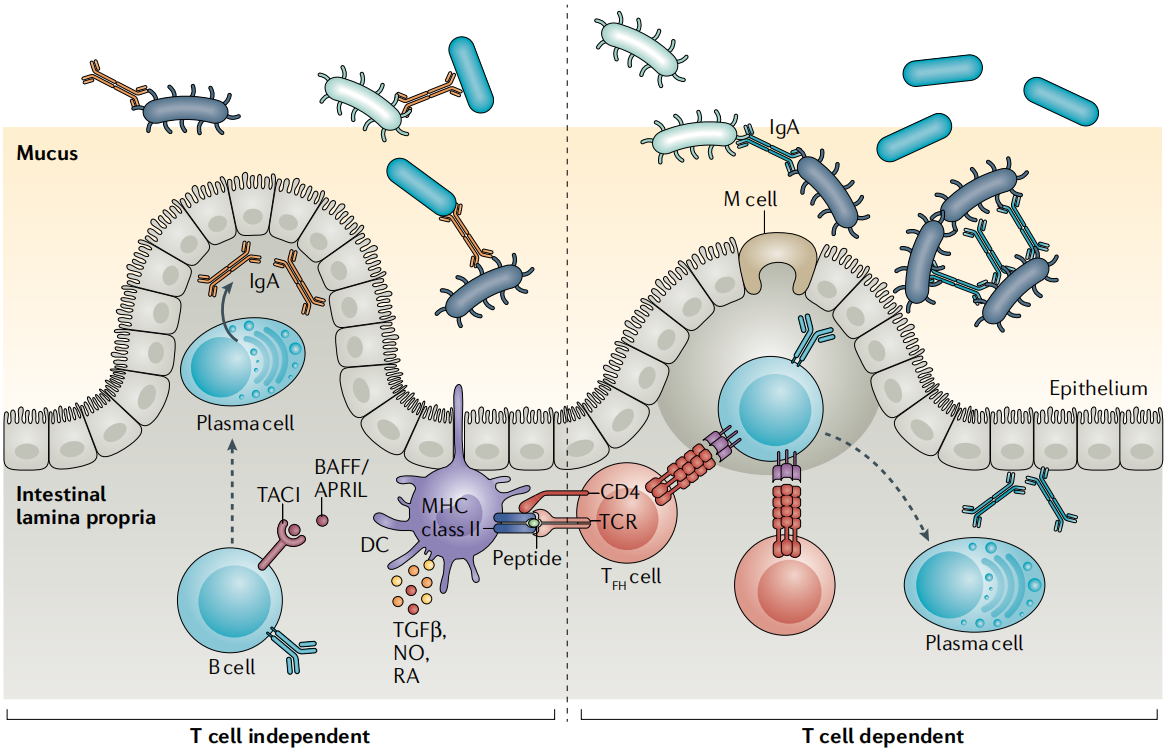
(数据来源 Kelsey E, et al. Nat Rev Immunol. 2021)
研究思路
SIgA是肠道分泌的主要抗体,但其功能效应与抗原特异性之间的关系尚不清楚,Rollenske团队通过解析单一微生物诱导的多克隆IgA应答如何并行地影响微生物生理与代谢。
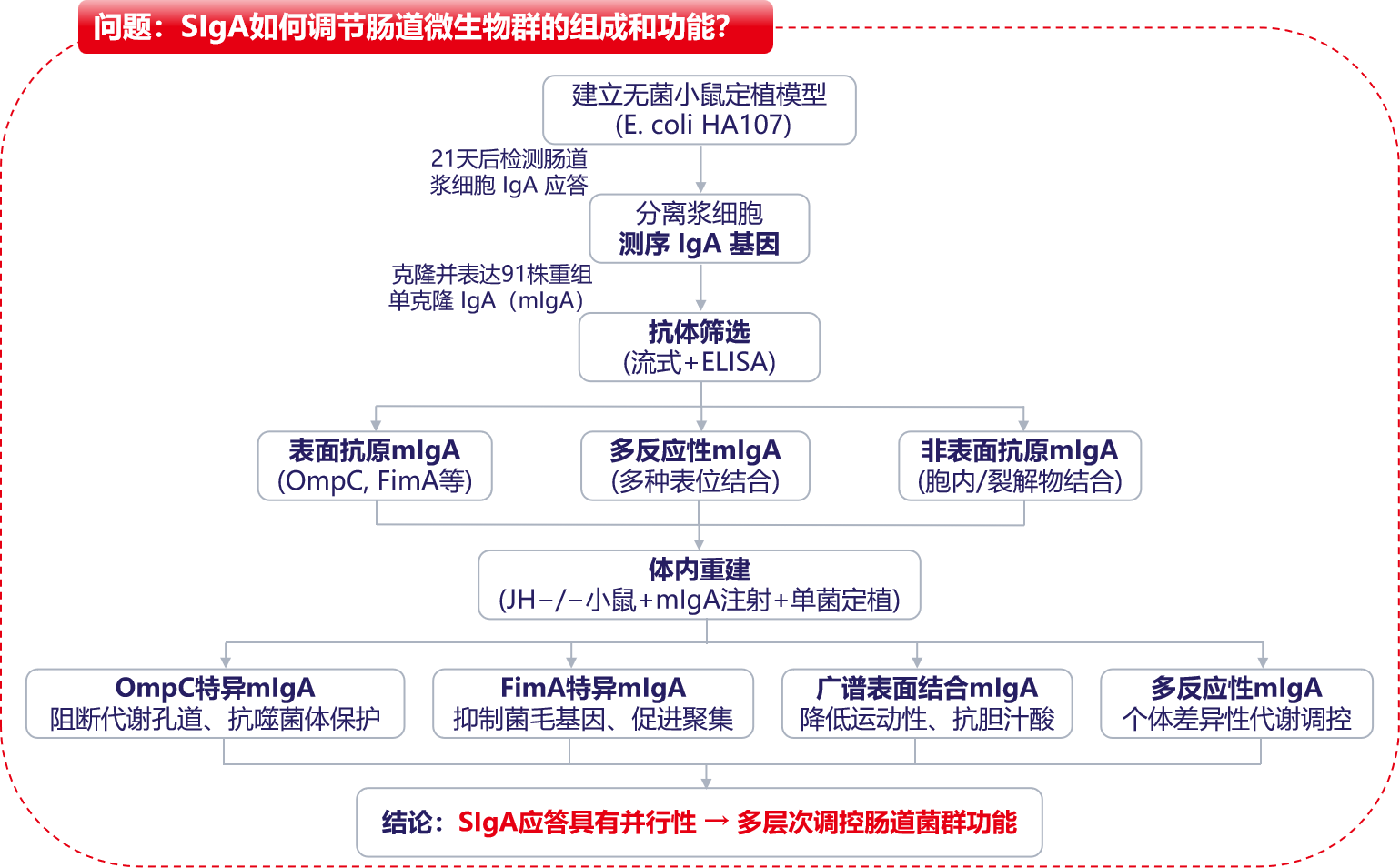
(数据来源 Tim R, et al. Nature. 2021)
研究结果
通过无菌野生型(WT)小鼠经胃内微生物E. coli-HA107预处理后,从固有层浆细胞获取HA107反应性单克隆抗体。克隆扩增IGHV和IGKV基因组合。

重组表达小鼠二聚体IgA的克隆抗体,流式细胞术检测鉴定活体完整HA107细菌表面包被的单克隆抗体,确定抗体结合特性。

重建模型后,通过ELISA检测单体mIgA或二聚体mIgA在胆管结扎(BDL)后静脉注射后的分泌与消除情况,揭示重组mSIgA的功能后果。

Rollenske及其同事研究了了分泌型免疫球蛋白A (SIgA)与肠道微生物群结合的后果。他们提出,SIgA的通用和独特表位特异性效应并行地调节肠道微生物群。SIgA调节肠道微生物群的组成和功能,并调节其与宿主的相互作用。
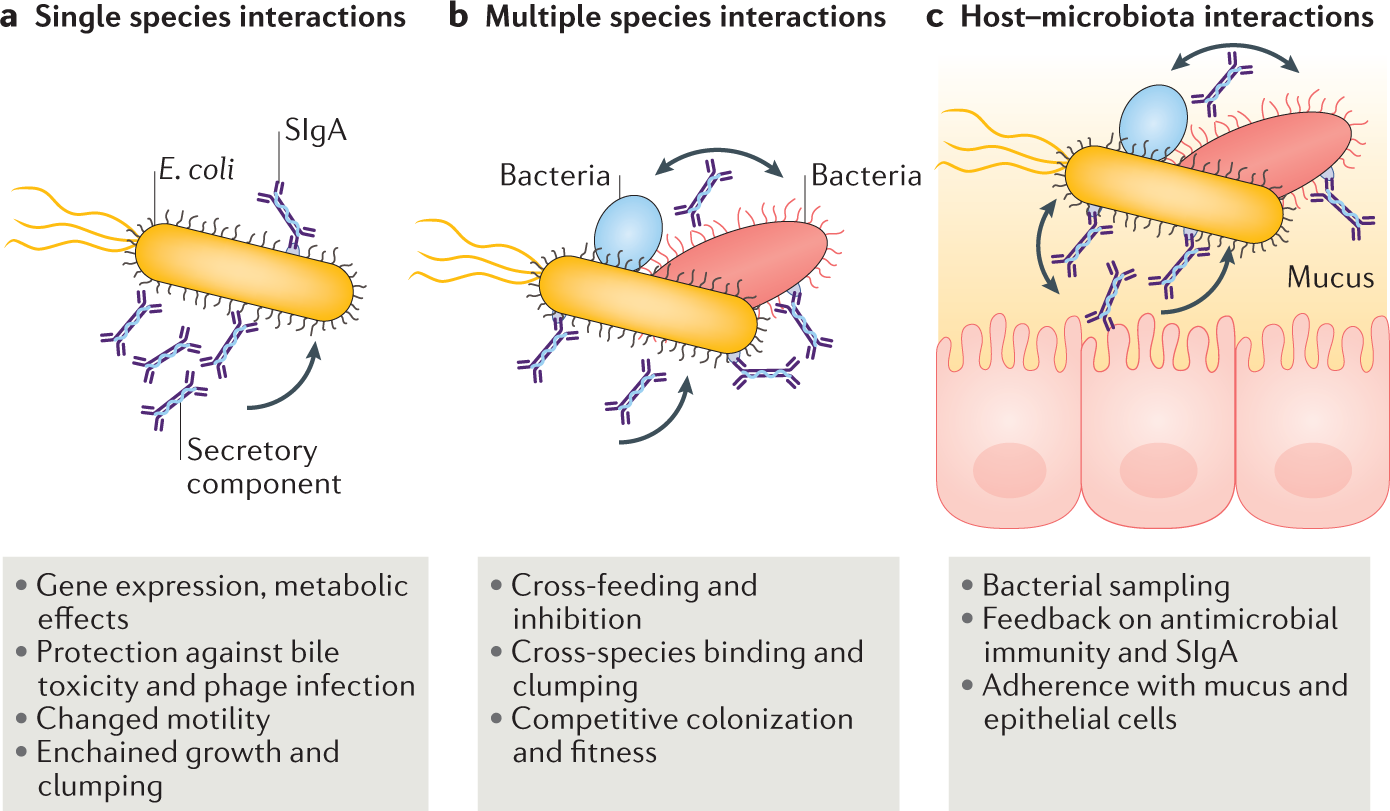
(数据来源 Oliver P, et al. Nat Rev Gastroenterol Hepatol. 2022)
IgA研究方法补充
IgA表达载体构建:IgAh 和 Igκ 或 IgJ链转录物通过PCR扩增,使用具有5′和3′端的引物,这些引物与各自的表达载体同源(小鼠IgA(Addgene质粒ID#244892),Igκ(Addgene质粒#127157),IgJ(Addgene质粒ID #244893));
重组单克隆二聚体鼠IgA表达:使用PEI介导的共同转染在HEK293F悬浮细胞中以等量转染IgAh,相应的Igκ和IgJ。24小时后加入等量培养基,在持续搅拌下培养额外5天,然后通过离心收集上清液。
亲和层析法纯化抗体:细胞培养上清液在4°C旋转摇床上与CaptureSelect LC-kappa亲和介质(Thermo Fisher Scientific)孵育过夜。去除上清液并将亲和介质转移到平衡好的柱子中,通过重力流出。重力柱用3柱体积(CVs)的PBS平衡,平衡后,将柱子放入一个空的收集管中,向柱子上加入250 µL 0.1 M柠檬酸缓冲液(pH 2.0),通过重力流出或施加轻度压力,并加入1:2.5体积的1 M Tris-HCl(pH 9)中和。使用带有100 kDa截止膜的离心浓缩器(Millipore)浓缩,并在4°C下用PBS或0.9%(w/v)NaCl透析过夜。
重组IgA检测:经纯化的IgA通过使用4%–20%预聚丙烯酰胺凝胶在还原或非还原条件下通过SDS-PAGE进行分析。
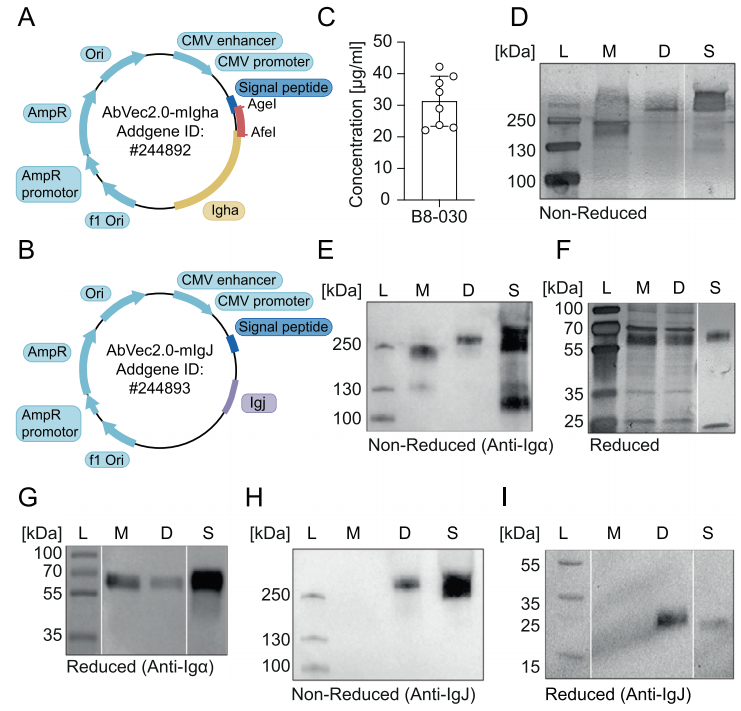
(数据来源 Antonia G, et al. Eur J Immunol. 2025)
