骨形态发生蛋白(BMPs)信号的失调在癌症中经常发生,并可能导致癌症干细胞(CSC)分化失调,促进肿瘤发生。GREM1是一种细胞增殖诱导基因2,是蛋白BMP的拮抗剂,也是一个分泌型的DAN家族半胱氨酸结蛋白成员,是TGF-β超家族成员,该家族的蛋白质通过结合并抑制骨形态发生蛋白(BMPs)如BMP2和BMP4的活性。Gremlin1已显示在胚胎发育过程中起重要作用,并促进上皮间质转变,Gremlin1在多个实体瘤中上调。
GREM1的表达分布
GREM1主要表达在心肌细胞中,在集合管细胞,卵泡颗粒细胞,粘液腺细胞,少突胶质细胞中有少量表达。
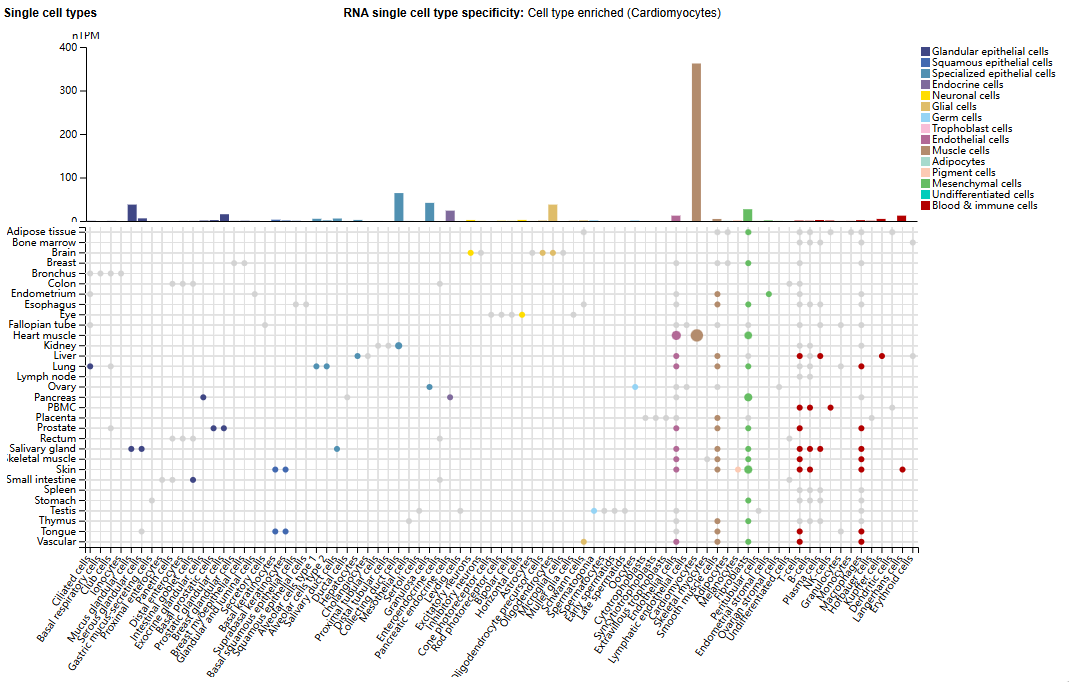
(数据来源 uniprot)
GREM1的结构和其受体
GREM1是一种分泌型骨形态发生蛋白(BMP)拮抗剂,其基因位于染色体15q13.3,由184个氨基酸组成,GREM1包含一个富含半胱氨酸的区域和半胱氨酸结模体,这对于与BMP结合至关重要。GREM1可以通过由第141位的半胱氨酸形成的分子间二硫键促进共价同二聚体的形成。与BMP类似,GREM1具有与肝素结合的能力,这一过程取决于11个关键的精氨酸和赖氨酸残基(如Lys90、Arg91和Lys145),这些残基分布在三个基本的残基簇中。
分泌型GREM1主要与细胞外基质和细胞膜表面的硫酸乙酰肝素蛋白聚糖(HSPGs)结合,将其定位限制在分泌细胞的附近区域,从而调节信号的激活过程并防止蛋白水解降解。

(数据来源 Jin Z, et al. Invest New Drugs. 2024)
GREM1在癌症中的信号通路
GREM1二聚体与BMP二聚体结合,以防止BMPR激活和R-SMAD1/5/8受体信号传导。GREM1与EGFR结合导致乳腺癌细胞中STAT3、ERK和AKT的磷酸化和激活,促进侵袭增加。GREM1二聚体与FGFR1结合导致RAS/ERK信号传导激活,并在对雄激素不敏感的前列腺癌细胞中驱动肿瘤进展。GREM1与VEGFR2结合驱动内皮细胞中VEGFR2的激活,导致血管生成。
CAFs特定亚群的GREM1表达增加导致上皮-间质转化和间质癌细胞形成,实体瘤形成和肿瘤细胞侵袭转移增加,这些都是结直肠癌和其他肿瘤患者预后较差的原因。
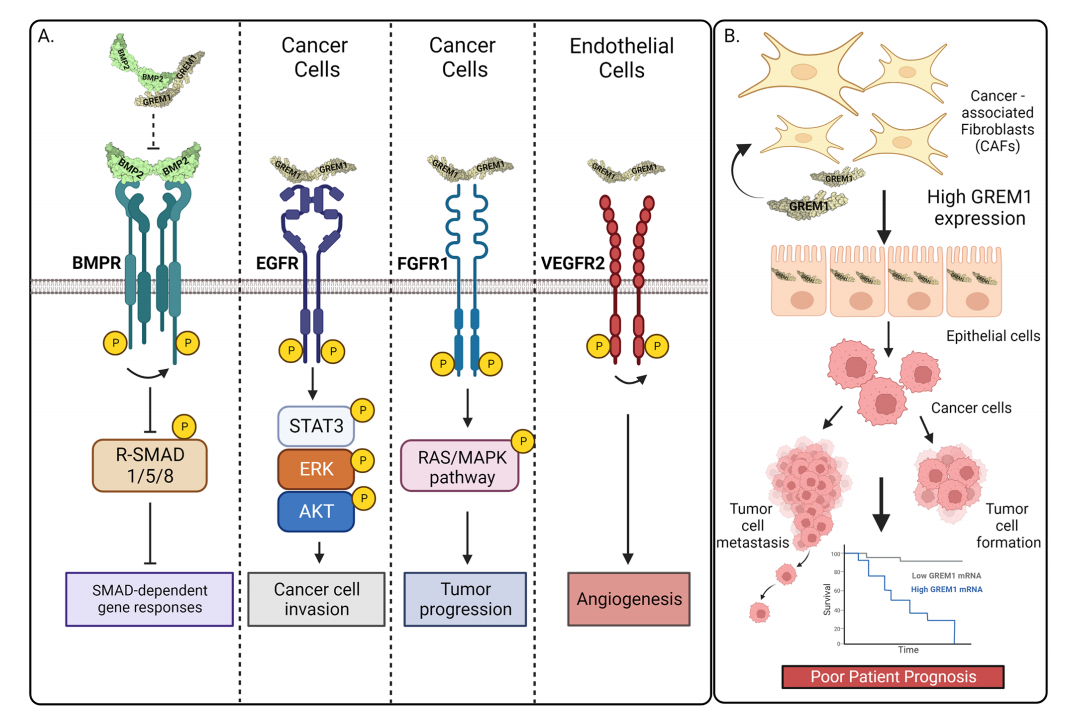
(数据来源 Gao Z, et al. J Cell Commun Signal. 2023)
癌干细胞(CSCs)表达高水平的BMP2,驱动CSC分化为癌细胞。CSCs也表达高水平的GREM1,它与BMP2结合并抑制其活性,防止分化并促进CSC自我更新和干性。
GREM1还调节Wnt信号通路,这是CSC调控的另一个重要途径。Wnt信号通路促进多种癌症中CSC的自更新和增殖。研究表明,Wnt调控的TCF7L2能够与GREM1增强子中的一个多态性位点紧密结合,从而增加GREM1的表达。通过调节Wnt信号通路,GREM1可能进一步增强CSC的干细胞样特性。据报道,GREM1能激活血管内皮生长因子受体-2(VEGFR2)信号通路,以促进血管生成。
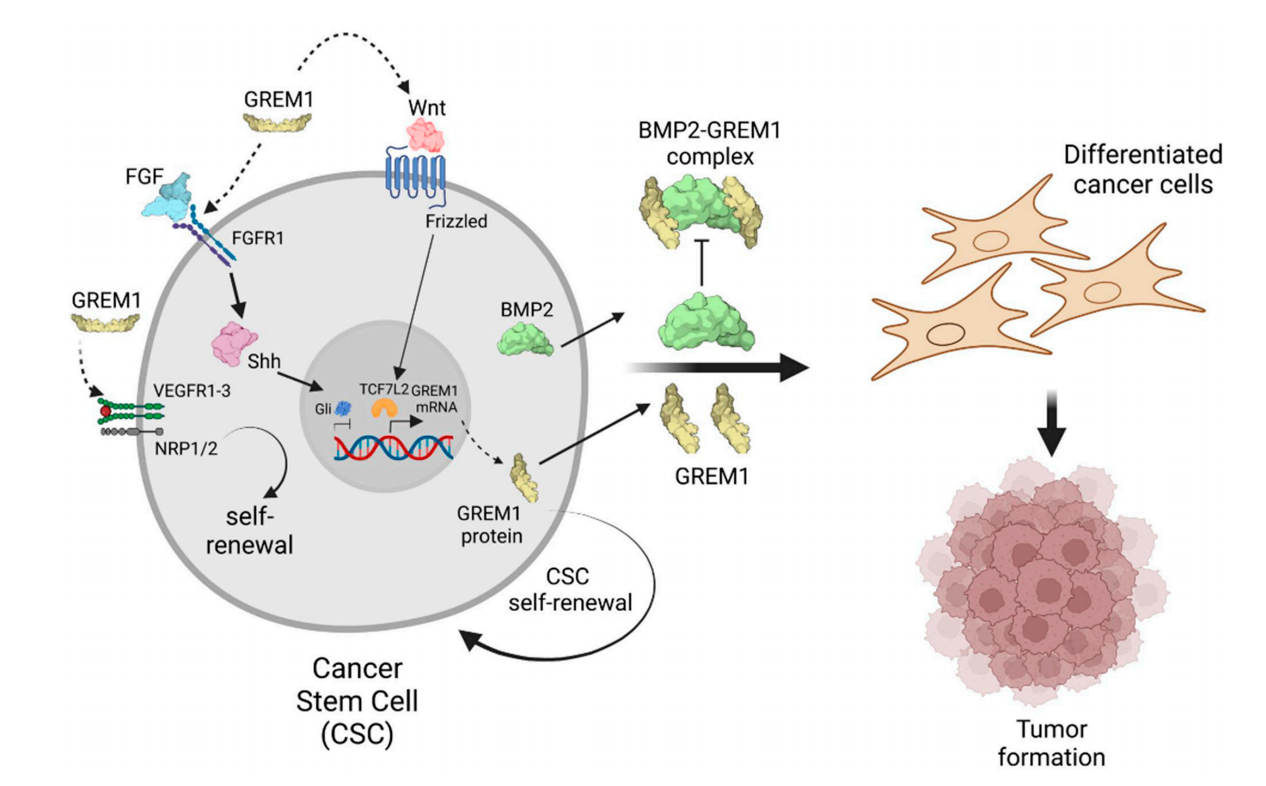
(数据来源 Gao Y, et al. Cells. 2025)
GREM1的靶向治疗
Ginisortamab(UCB6114)是一种由由UCB开发的靶向GREM1的单克隆抗体,目前处于临床1/2期研究阶段,NCT04393298是一项研究旨在评估静脉注射UCB6114对晚期实体瘤患者的安全性、药代动力学和抗肿瘤活性。
TST003是苏州创胜医药集团开发的靶向Gremlin1的高亲和力人源化IgG1单克隆抗体,用于治疗前列腺癌,NSCLC,CRC,ESCC,GC,PADC,乳腺癌等。TST003可阻断GREM1与BMP2/4的结合,增强BMP信号通路。在对检查点抑制剂耐药的难治性实体瘤(包括去势抵抗性前列腺癌和微卫星稳定的结直肠癌)的患者来源的异种移植瘤模型中,TST003显示出有前景的单药和联合活性。NCT05731271是在局部晚期或转移性实体瘤患者中进行的第一项人类1期研究,患者在之前的治疗期间或之后出现肿瘤进展,并且没有可以带来临床获益的标准疗法。

(数据来源 transcenta官网)
我们收集整理一批GREM1相关抗体序列信息。文档可关注公众号,号内回复“ GREM1 ”下载。

