表皮生长样子蛋白7(EGFL7)在体内调控血管管状形成。抑制血小板源性生长因子(PDGF)-BB诱导的平滑肌细胞迁移,促进内皮细胞与细胞外基质的粘附及血管生成。EGFL7还与先兆子痫、中风、多发性硬化症(MS)和癌症等多种疾病有关。
EGFL7的表达分布
EGFL7主要表达在脂肪细胞、内皮细胞、淋巴管内皮细胞、霍夫鲍尔细胞、精原细胞中。EGFL7在胚胎期高表达于增殖活跃的血管内皮细胞,但在健康成年组织中表达显著受限,仅肺组织等少数器官维持较高水平。但在特定病理状态(尤其是癌症和损伤修复)下被重新激活。

(数据来源 uniprot)
EGFL7的结构
EGFL7位于人的第9号染色体上,是一种分泌蛋白,分子量约为30kDa,包含多个结构域,信号肽,与细胞外基质蛋白相互作用的Emilin样结构域(EMI)。两个EGF样结构域;第一个EGF样结构域包含RGD基序,可与整合素(如αvβ3)结合;第二个EGF样结构域可结合钙离子,增强蛋白稳定性。C端卷曲螺旋结构域;可能参与蛋白寡聚化。
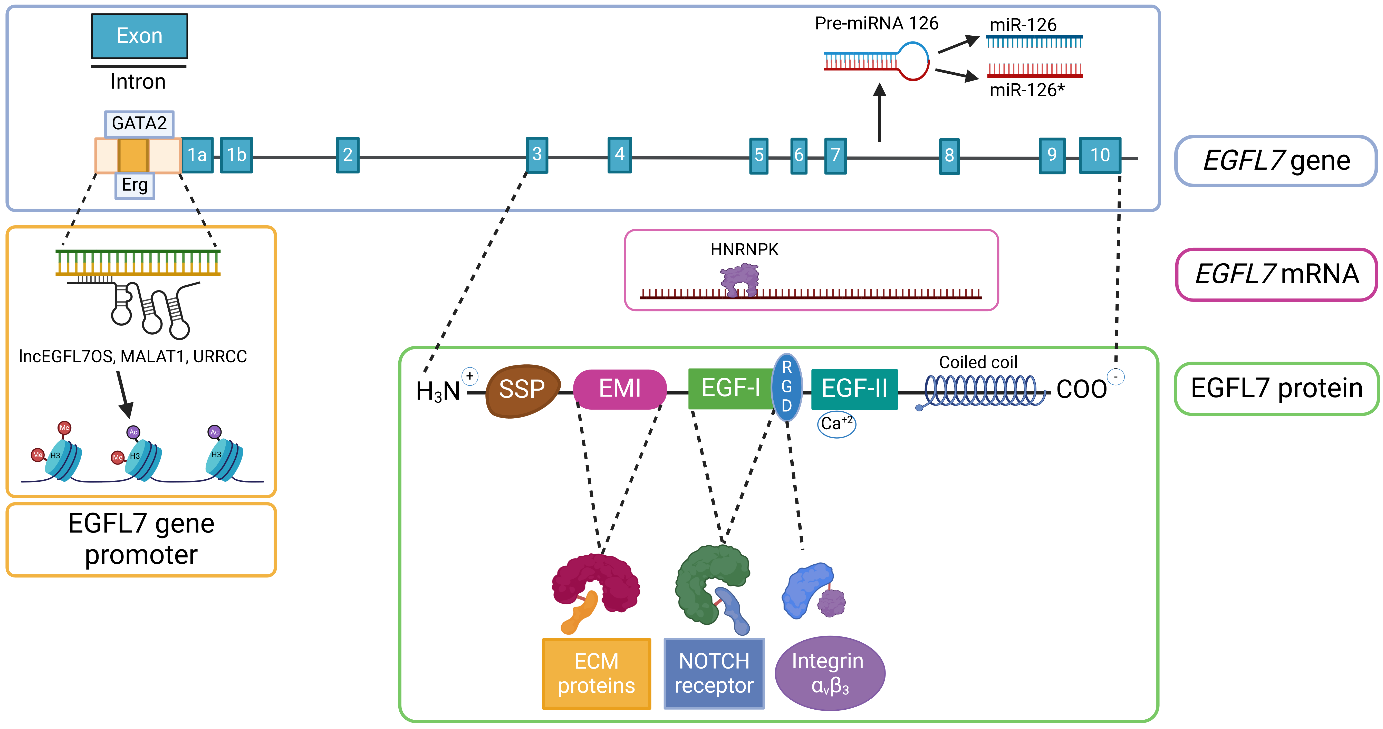
(数据来源 Fabian C, et al. Pharmacol Ther. 2025)
EGFL7在疾病中的调控
EGFL7的表达受到众多因素通过多种机制的严格调控。这些调控机制的紊乱可能会导致蛋白质表达失常,从而可能引发多种病理状况。EGFL7表达的调节变化已被认为是多种疾病(包括先兆子痫、中风、多发性硬化症以及多种肿瘤类型)的致病原因。
在内皮细胞中,EGFL7抑制B细胞抑制因子α(IκBα)中核因子κB轻链基因增强子的降解,从而阻断核因子κB(NF-κB)信号传导。这阻碍了免疫应答基因的激活并防止了炎症。炎症期间的TNFα表达会抑制EGFL7,从而引起免疫反应的激活。
EGFL7在健康大脑中的表达相对较高,这阻止了T细胞浸润脑实质。因此,T细胞优先留在血管周围间隙。
在MS影响的大脑中,EGFL7低水平表达,导致BBB的破坏。这导致CD4阳性T细胞向脑实质浸润。T细胞与小胶质细胞相互作用并激活小胶质细胞,小胶质细胞是大脑的常驻免疫细胞。小胶质细胞释放细胞因子,引起神经元脱髓鞘和轴突变性。
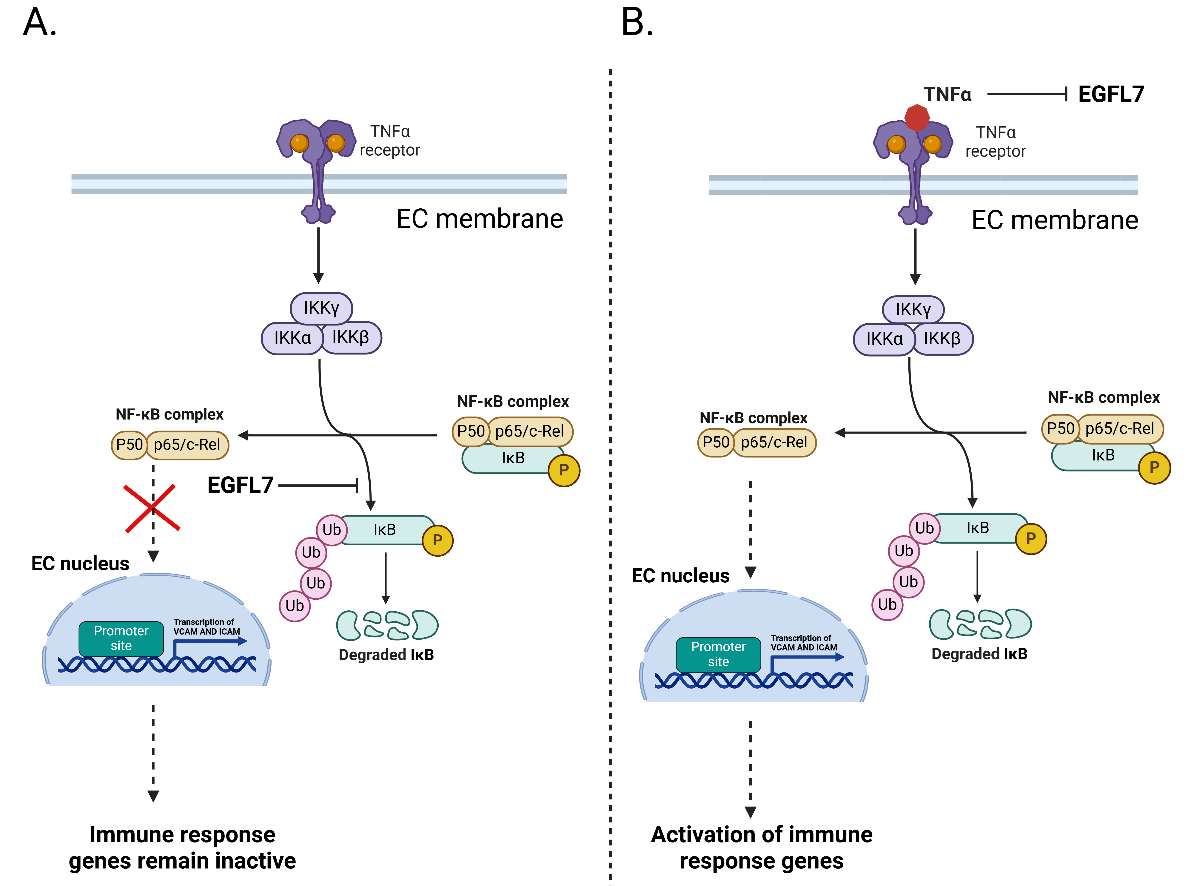
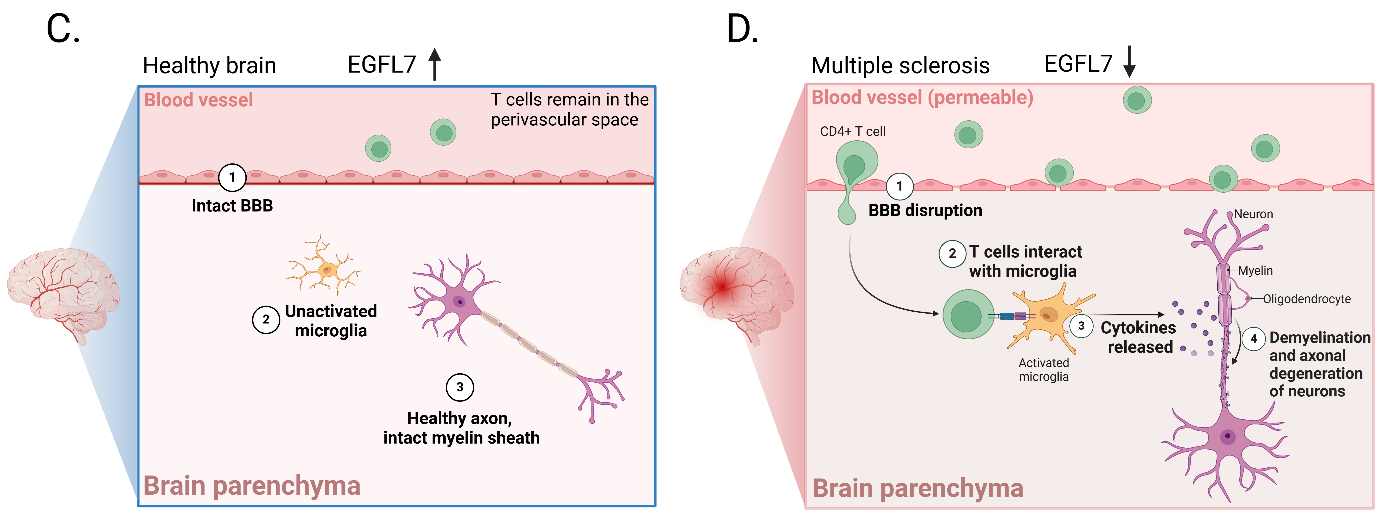
(数据来源 Fabian C, et al. Pharmacol Ther. 2025)
EGFL7在癌症中的作用
EGFL7表达的上调及其在血管生成和免疫逃逸中的参与可能促进了肿瘤的加速进展。
在胶质瘤中,肿瘤血管分泌的EGFL7通过与整合素α5β1的结合促进血管生成,从而促进肿瘤生长。EGFL7通过下调内皮细胞上的黏附分子ICAM-1和VCAM-1,减少免疫细胞黏附,参与了乳腺癌和肺癌的免疫逃逸。在多发性骨髓瘤中,EGFL7与ITGB3和KLF2形成正反馈环路,促进肿瘤细胞存活。
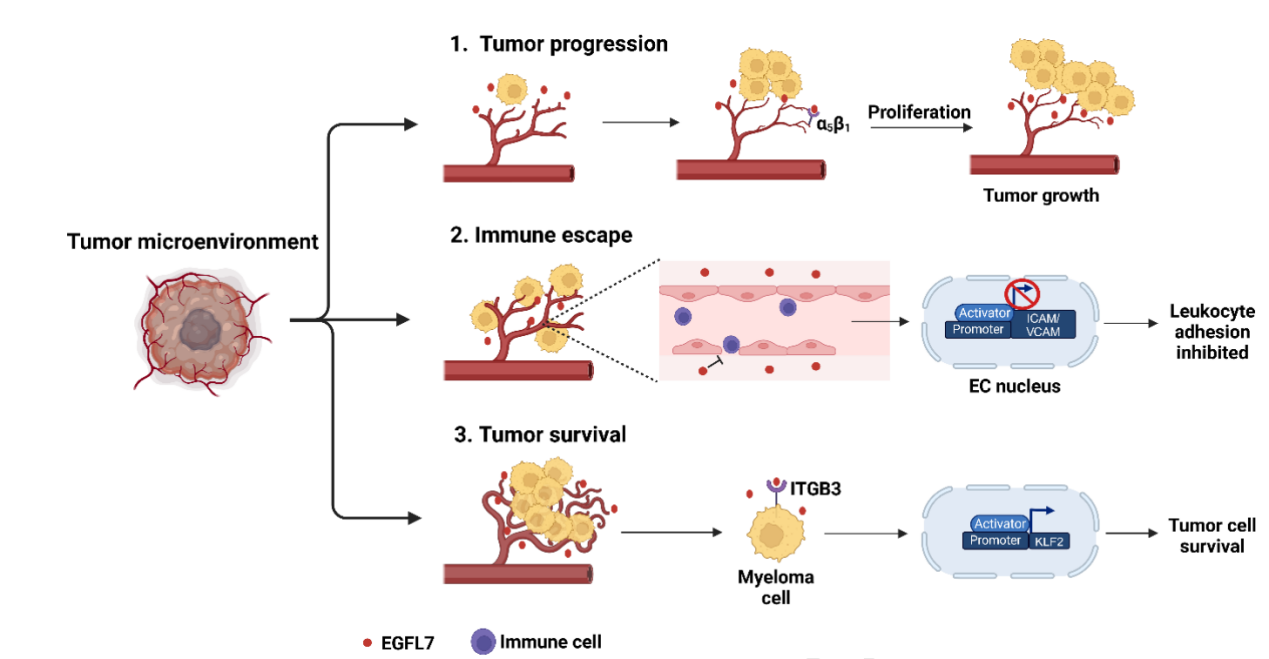
(数据来源 Fabian C, et al. Pharmacol Ther. 2025)
EGFL7的靶向治疗
EGFL7在疾病中的治疗潜力在生理学上,EGFL7调节不同的生物学过程,如血管生成,血管发生或神经发生。在病理状态下,使用EGFL7拮抗剂联合抗αvβ3治疗可能抑制肿瘤生长并缓解卒中症状。使用EGFL7激动剂治疗先兆子痫,同时使用TNFα拮抗剂治疗MS可能对这些疾病患者有益。

(数据来源 Fabian C, et al. Pharmacol Ther. 2025)
Parsatuzumab是一种选择性阻断EGFL7与内皮细胞相互作用的抗EGFL7抗体,一项II期随机临床试验显示,在转移性结直肠癌患者中,Parsatuzumab联合FOLFOX+贝伐珠单抗的治疗方案,未能提高疗效。由于Parsatuzumab在II期临床试验中并未显示出预期的疗效,目前暂无其最新的研究进展。
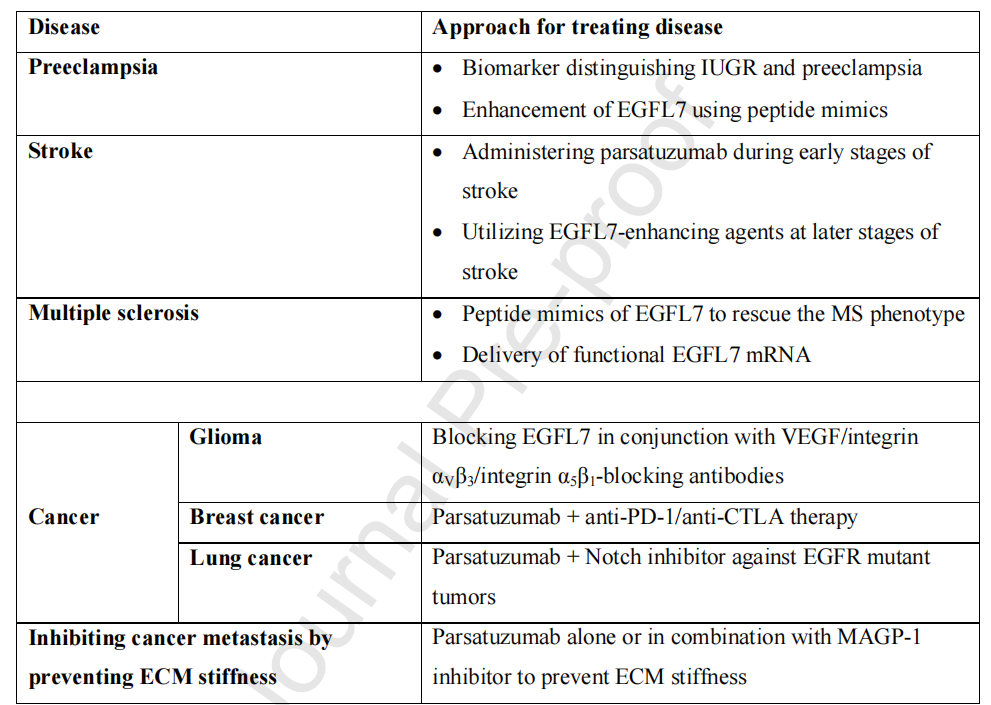
(数据来源 Fabian C, et al. Pharmacol Ther. 2025)
我们收集整理一批EGFL7相关抗体序列信息。文档可关注公众号,号内回复“ EGFL7”下载。
