服务支持
迈思生物承担了该研究中EGFR (25-645)、EGFR (669-1210) 截断体、NEK7活性酶蛋白的定制开发及SPR互作检测服务。

(数据来源 项目活性蛋白开发数据)
背景
肝细胞癌(HCC)作为最常见的肝癌类型,因其位列第六大常见癌症且是癌症相关死亡的首要原因,被列为全球第四大致死疾病。Lenvatinib是不可手术的肝细胞癌(HCC)患者的一线治疗药物。但是持续存在的Lenvatinib会对HCC细胞产生选择性压力,导致HCC复发,因此需要研究Lenvatinib耐药的机制。越来越多的证据表明,Lenvatinib耐药可通过激酶重排机制在肝癌细胞中获得。

华中科技大学同济医学院附属同济医院肝脏外科中心黄岐伯在《Hepatology》(IF=15.8)上发表了一篇名为“NEK7 induced phosphorylation of EGFR on serine 1070 drive the acquired lenvatinib resistance in hepatocellular carcinoma”的文章。该研究确定NEK7通过直接结合EGFR并磷酸化EGFR的丝氨酸1070来促进获得性lenvatinib耐药过程。针对从氨基酸979到1099的域设计的抑制肽被证明可以抑制EGFR S1070位点的磷酸化和治疗性地抑制获得性lenvatinib抵抗小鼠肝癌细胞的抗肿瘤作用。
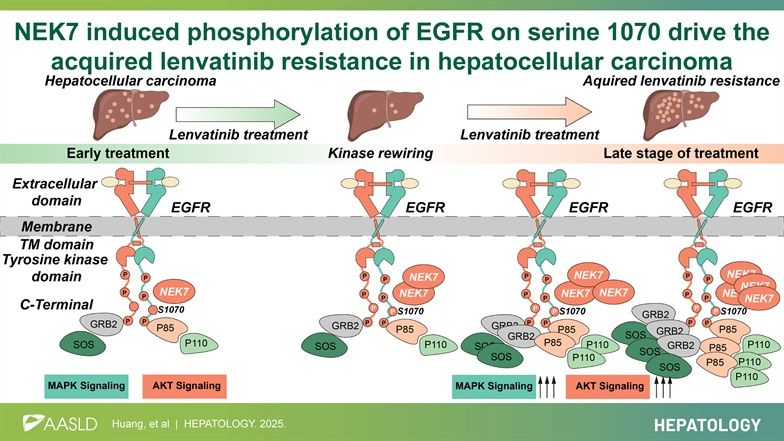
NEK7为肝细胞癌中获得性耐药于lenvatinib的基因
构建了获得性lenvatinib耐药的患者来源类器官(ALR-PDOX)模型,通过CRISPR-Cas9激酶敲除文库筛选出NEK7作为关键耐药基因。NEK7是HCC治疗中获得性lenvatinib耐药的关键激酶。

抑制NEK7蛋白能够提高肝细胞癌对lenvatinib的敏感性
在体内外模型中,NEK7的敲除显著降低了HCC细胞对lenvatinib的IC50值,小鼠的肿瘤数量和最大肿瘤体积均显著减少,且NEK7的表达水平与lenvatinib耐药相关。在肝细胞中特异性敲除Nek7基因能有效抑制Trp53 KO /MYC OE模型获得性lenvatinib耐药。在皮下植入肿瘤模型中,敲低NEK7基因通过增强lenvatinib的疗效抑制了肿瘤进展。敲低或敲除NEK7基因可恢复lenvatinib的疗效,并在体外和体内实验中抑制获得性耐药性的发展。

NEK7通过EGFR信号通路促进获得性lenvatinib耐药
NEK7是一种丝氨酸/苏氨酸激酶,通过向靶蛋白上的特定丝氨酸或苏氨酸残基添加磷酸基团发挥关键作用。EGFR信号通路及其下游的MAPK和PI3K/AKT信号通路均受到NEK7的影响。表敲低NEK7可抑制MAPK和PI3K/AKT信号通路的激活。
使用Crispr/Cas9技术在Hep3B LR和Huh7 LR细胞中构建了EGFR敲除细胞系探究了NEK7和EGFR的关系,结果发现EGFR敲除显著抑制了Hep3B LR和Huh7 LR细胞的增殖能力,且这些细胞在来那替尼治疗后的半抑制浓度值低于LR载体组。当NEK7的过表达也无法挽救EGFR敲除后下游抑制作用的缺失。并且体内实验进一步证实,即使在lenvatinib治疗下,NEK7过表达也无法挽救EGFR敲除后异种移植瘤的生长。NEK7以EGFR依赖性的方式促进肝癌细胞获得性lenvatinib耐药。

EGFR的C端尾残基S1070被NEK7磷酸化
通过构建多种截短形式的EGFR,发现全长的EGFR和截短的EGFR均能与NEK7相互作用,通过体外实验GST下拉实验证实胞内段EGFR(669-1210)与NEK7存在直接结合。
通过磷酸化质谱分析发现NEK7激活EGFR时会涉及S1026和S1070磷酸化位点,并通过免疫共沉淀实验证明S1070对NEK7过表达诱导的EGFR的泛磷酸化水平具有关键作用。并且EGFR的S1070在各个物种中都具有高度保守性,通过体外磷酸化实验验证了NEK7能够对EGFR S1070位点进行磷酸化修饰。

EGFR末端尾部的S1070位点的磷酸化会促进EGFR、P85和GRB2之间的相互作用
EGFR信号通路在调控MAPK和PI3K/AKT信号通路中起关键作用,当GRB2蛋白C端尾部发生磷酸化后,其SH2结构域会结合并招募SOS复合体,进而激活MAPK信号通路。研究表明,PI3K的调节亚基P85的SH2结构域也具有类似功能。
通过外源过表达和内源蛋白定量免疫共沉淀实验证实P85和GRB2与EGFR的相互作用能力也因S1070A突变而减弱。NEK7过表达导致EGF刺激后P85和GRB2在膜上聚集。而敲低NEK7则抑制了EGF对P85和GRB2膜募集的促进作用。EGFR S1070A突变可能限制了P85-EGFR复合物的形成。通过EGFR-P85和EGFR-GRB2通路介导的lenvatinib耐药机制中,EGFR S1070位点的磷酸化修饰起着关键作用,互相影响。

NEK7诱导的EGFR C末端尾部残基S1070磷酸化可促进lenvatinib的获得性耐药
EGFRC端尾部残基S1070与NEK7的表达水平,与来那替尼治疗效果及肝癌恶性进展密切相关。EGFR S1070磷酸化位点可作为来那替尼治疗后患者的预后预测标志物。

药理学阻断EGFR S1070可减轻HCC获得性lenvatinib耐药
通过利用Alphafold数据库获取EGFR的C端尾部的979-1099的结构信息,设计出2段具有细胞穿透特性的多肽TAT,通过体内外实验发现TAT-pep10能显著抑制Hep3B LR细胞中MAPK和PI3K/AKT信号通路的激活。在用TAT-pep10处理细胞后,定量共免疫沉淀实验表明,在293T 细胞中,EGFR与NEK7、P85和GRB2的相互作用以浓度依赖的方式受到抑制。TAT-pep10以浓度依赖的方式抑制了Hep3B LR细胞中EGFR S1070的磷酸化及其下游通路。
表面等离子体共振(SPR)检测显示TAT-pep10能与EGFR细胞膜内段残基(669-1210位点)相互作用。
NEK7介导的EGFR S1070磷酸化在获得性lenvatinib耐药中起关键作用,因此靶向EGFR C端尾部残基S1070可能是治疗该耐药性的潜在策略。

总结
该研究发现了一个新的EGFR磷酸化位点S1070。NEK7在lenvatinib获得性耐药的发生中起着至关重要的作用。此外,NEK7介导的EGFR上S1070位点的磷酸化对细胞膜上GRB2和P85的刺激至关重要,而GRB2和P85是MAPK和PI3K/AKT信号通路的调节亚基。NEK7介导的EGFR S1070磷酸化不仅与lenvatinib获得性耐药有关,而且与较差的总生存期呈正相关。抑制EGFR C端尾部的药理作用增强了lenvatinib治疗的有效性,并抑制了HCC的进展。综上所述,该研究扩展了对NEK7介导的EGFR磷酸化在HCC lenvatinib替获得性耐药中的理解,并突出了EGFR C末端作为靶点治疗获得性lenvatinib耐药的潜力。
