肿瘤抗原5T4/WAIF1(Wnt激活抑制因子1;也称为滋养层糖蛋白TPBG)是多癌症免疫治疗临床试验中靶向的细胞表面蛋白。TPBG可能通过间接与LRP6相互作用并阻止Wnt3a依赖的LRP6内化来作为Wnt/β-连环蛋白信号的抑制剂。
TPBG的表达分布
TPBG主要表达在基底呼吸细胞,胞外滋养细胞,间皮细胞中,TPBG在胚胎发育期广泛表达于胎盘滋养层细胞,参与胚胎植入和胎盘形成。

TPBG在多种实体瘤中显著高表达(阳性率高达80%),且表达水平与肿瘤侵袭性和不良预后直接相关。包括非小细胞肺癌、肾癌、胰腺癌、前列腺癌、乳腺癌、结直肠癌、胃癌、卵巢癌和宫颈癌。5T4在正常组织上的表达有限,使其成为癌症免疫治疗的有吸引力的靶点。
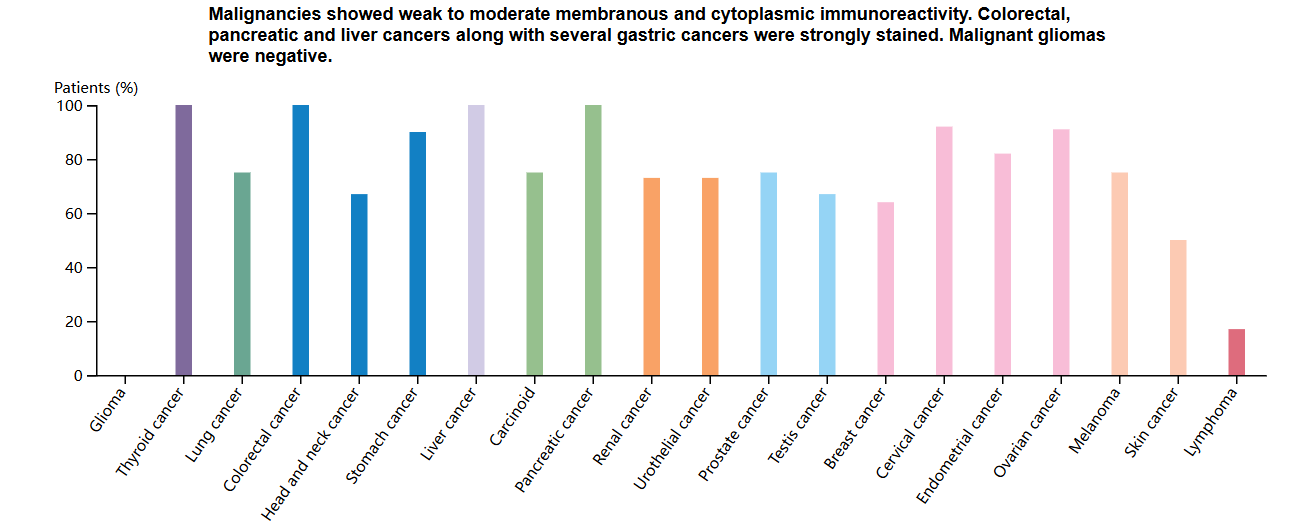
(数据来源 uniprot)
TPBG的结构和其受体
TPBG是一种I型跨膜蛋白,由420个氨基酸组成,包括N端胞外区,跨膜区,C端胞内区。
胞外域包含7个LRR(亮氨酸富集重复序列)模体,介导蛋白质间相互作用,参与细胞黏附和信号传导。胞质尾部含PDZ结构域,介导细胞骨架相互作用。
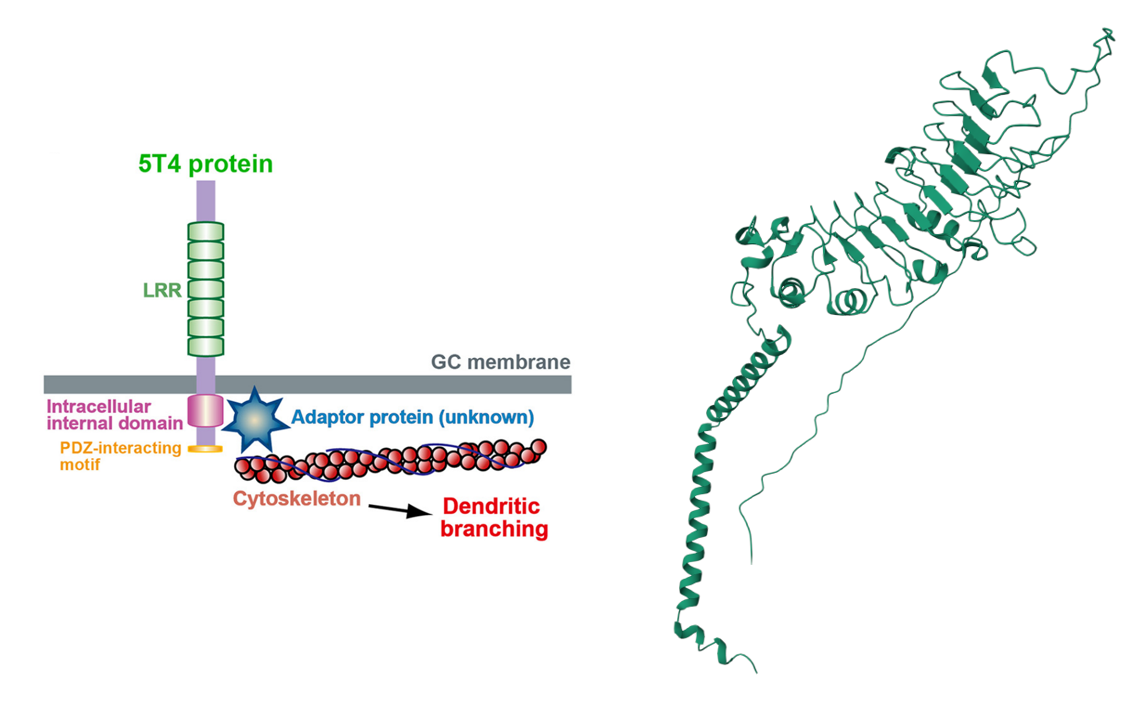
(数据来源 Tsuboi A. Front Mol Neurosci. 2020)
TPBG的功能
TPBG对Wnt通路发挥双向调节作用
抑制经典Wnt/β-catenin通路:通过DKK1蛋白诱导LRP5/6内吞,阻断Frizzled-LRP5/6复合物形成,导致β-catenin降解,抑制细胞分化和粘附。
激活非经典Wnt通路:通过DKK1-JNK轴激活Rho/Rac GTPases,促进细胞骨架重组和运动性增强,驱动肿瘤转移,这种双重调控使肿瘤细胞在丧失分化能力的同时获得强迁移性,是转移的重要机制。
上皮-间质转化(EMT)
上皮-间质转化(EMT)在肿瘤侵袭和转移过程中起着重要作用。TPBG 诱导 E-钙黏蛋白表达下调,增强细胞骨架肌动蛋白重组,减弱细胞粘附,促进细胞形态变化和转移。
这三条通路并非独立运作,TPBG诱导的EMT可增强CXCR4表达,而Wnt非经典通路与CXCL12协同促进转移,形成促癌正反馈循环。
CXCL12/CXCR4生物轴调节
TPBG与CXCR4共定位于细胞膜,增强CXCL12介导的趋化反应;在TPBG缺失时,CXCL12转而结合CXCR7,激活Ras-Raf-MAPK和PI3K-Akt促生存通路。
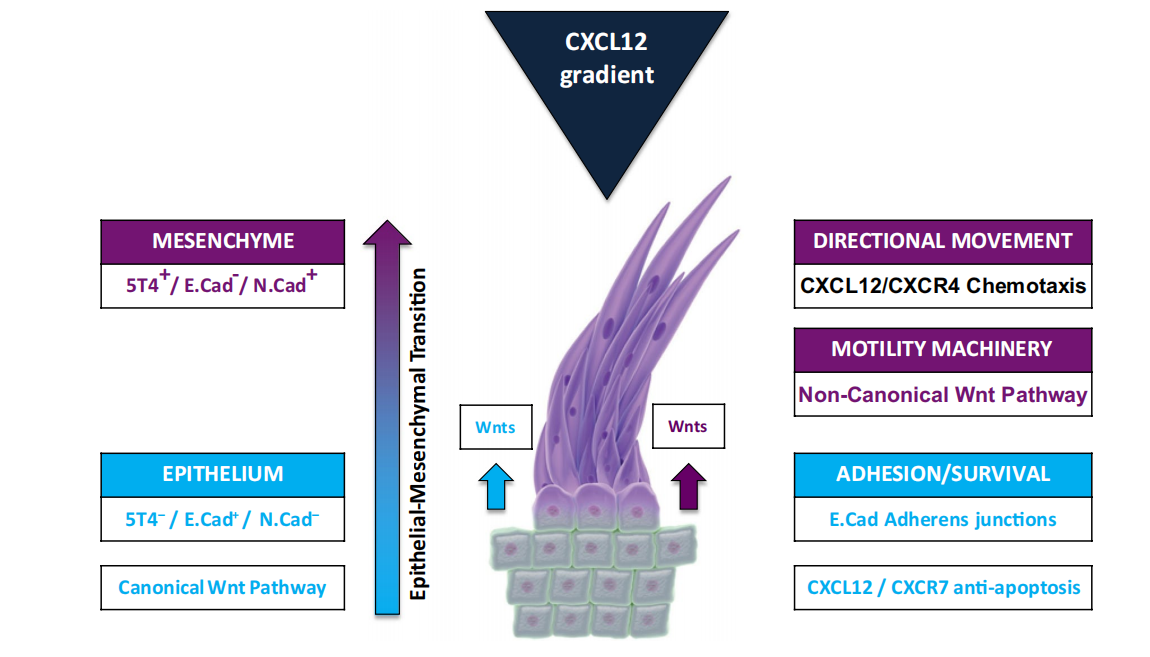
(数据来源 Stern PL, Cancer Immunol Immunother. 2017)
TPBG的靶向治疗
由于TPBG的肿瘤特异性表达,多种靶向疗法已进入临床开发,包括抗体偶联药物(ADC)、肿瘤疫苗、双特异性抗体和细胞疗法。其中ADC药物研发最多。
Naptumomab estafenatox(naptumomab)是一种靶向TPBG的肿瘤靶向免疫疗法,能够增强免疫系统识别和杀死肿瘤的能力。Naptumomab由Active Biotechs的合作方NeoTX开发,用于治疗实体肿瘤。Naptumomab,一种称为肿瘤靶向超抗原(TTS)的融合蛋白,包含一种抗体的Fab片段,该抗体结合于许多不同类型的实体肿瘤上表达的肿瘤抗原5T4。Naptumomab的抗体部分与一种细菌超抗原结合,该超抗原激活具有特定T细胞受体的T细胞。naptumomab通过激活体内免疫系统的T细胞并引导它们向肿瘤上的5T4蛋白起作用。这导致肿瘤内聚集大量激活的T细胞并杀死肿瘤细胞。
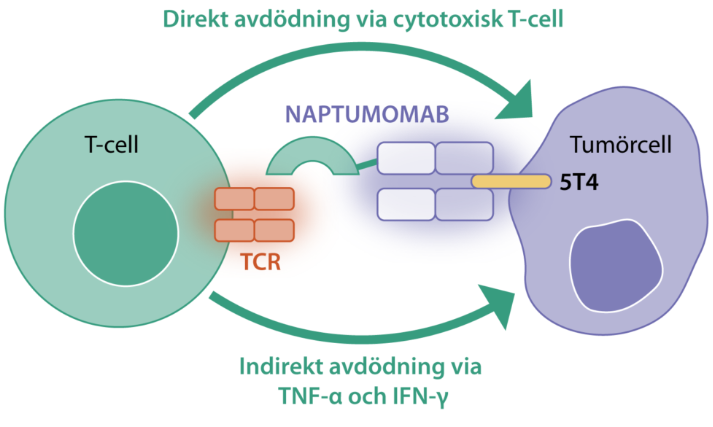
目前该抗体正在进行2项临床研究,一项开放性、多中心、剂量探索的Ib/II期研究,使用Naptumomab联合检查点抑制剂(度伐利尤单抗)。结果表明在推荐的II期剂量下,Naptumomab联合度伐利尤单抗耐受性良好,毒性有限。包括完全的,在患者中观察到了治疗反应,这些患者的反应对仅有的检查点抑制剂不预期。使用B细胞疗法obinutuzumab的过度治疗会减少对naptumomab的抗药性抗体的生成。计划对患有卵巢癌的患者进行这项研究的队列扩展。
在美国进行的一项开放性IIa期研究,评估在先前接受过检查点抑制剂治疗的转移性或晚期非小细胞肺癌(NSCLC)患者中,Naptumomab联合多西他赛的疗效。并于2024年6月在美国临床肿瘤学会(ASCO)上公布了结果。Naptumomab与多西他赛的联合治疗显示出初步的活性,但与单独使用多西他赛相比,总反应率没有增加(主要终点)。在这些强效预处理的NSCLC患者中,这种联合治疗的安全性是可接受的。

(数据来源 Active Biotech官网)
ACR246是杭州爱科瑞思开发的一款同类最佳且可能率先上市的ADC产品,靶向5T4胎儿抗原,使用一种专利的拓扑异构酶I抑制剂,已于2024年1月在中国获得临床试验批准,首个人体研究(FIH)试验计划于2024年第一季度启动。ACR246处于肿瘤创新的前沿,设计有稳定且可在肿瘤微环境(TME)切割的连接子,并在涉及啮齿动物和非人类灵长动物模型的预临床研究中显示出显著的抗肿瘤活性、安全性和药代动力学及耐受性。5T4的特异性主要表达于各种实体肿瘤,并且在正常成体组织中表达极低,这突显了ACR246在广泛肿瘤应用中的潜力,并标志着精准肿瘤学的新纪元。

(数据来源 adcoris官网)
JK-06由Salubrisbio开发的一款ADC,正在进行1期剂量递增研究,用于不可切除的局部晚期或转移性癌症患者。
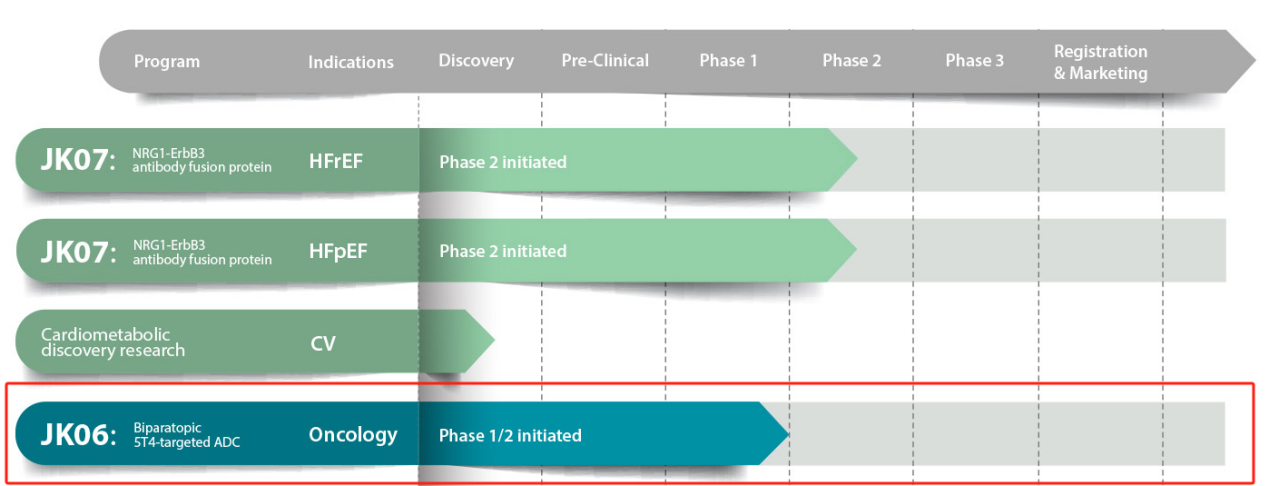
(数据来源 Salubrisbio官网)
TUB-030是Tubulis开发的一种靶向5T4的ADC,这是一种在多种实体肿瘤中表达的与癌症相关的抗原。它由一种针对5T4的IgG1抗体和通过公司专利的P5偶联技术连接在一起的拓扑异构酶I抑制剂艾沙康单抗组成,药物与抗体的比例(DAR)为8。P5偶联是一种针对半胱氨酸选择性偶联的新型化学方法,能够以前所未有的连接子稳定性和优越的生物物理特性生成ADC。
临床前药代动力学分析显示,TUB-030能够有效地将有效载荷输送到肿瘤部位,同时减少非靶向毒性。候选药物在多种临床前实体瘤模型中表现出有效的和持久的反应,即使在较低的靶标表达水平下也是如此,并且具有出色的的安全性概况。TUB-030目前正在多中心I/IIa期研究(5-STAR 1-01,NCT06657222)中进行研究,旨在评估TUB-030作为单药治疗晚期实体瘤患者的安全性、耐受性、药代动力学和疗效。

(数据来源 tubulis官网)
ALG.APV-527是一种双特异性抗体,靶向免疫共刺激受体4-1BB和肿瘤相关抗原5T4。APV-527指导5T4+肿瘤对CD8+T和NK细胞的刺激,并被设计为最大限度地减少其他4-1BB疗法观察到的毒性。ALG.APV-527I期研究(NCT05934539)是一项首次在人体中进行的开放标签、多中心试验,包括多达6个队列(0.1 ~ 15 mg/kg),ALG剂量增加3+3。APV-527单药治疗,静脉给药,每2周1次,用于晚期实体瘤成人患者。纳入标准仅限于肿瘤类型可能表达5T4抗原的患者。ALG.APV-527具有良好的耐受性、安全性和生物学活性。
剂量增加实验结果发现在所有患者中均能检测到 ALG.APV-527,其血清浓度与给药剂量及预测暴露量相符;生物标志物分析表明,在肿瘤活检中,靶点(4-1BB和5T4)的表达,治疗导致血液中可溶性4-1BB增加,肿瘤中CD8 T细胞的总体数量增加,证实了ALG.APV-527的生物活性。研究中,持续时间最长的疾病稳定状态出现在一名乳腺癌患者身上,该患者入组时病情进展,后达到疾病稳定状态,并在研究中持续了超过11个月。这名患者成功两次提升剂量水平。一名结肠癌患者在研究中保持疾病稳定状态达六个月。一名前列腺癌患者病情稳定,在研究中持续了超过四个月。
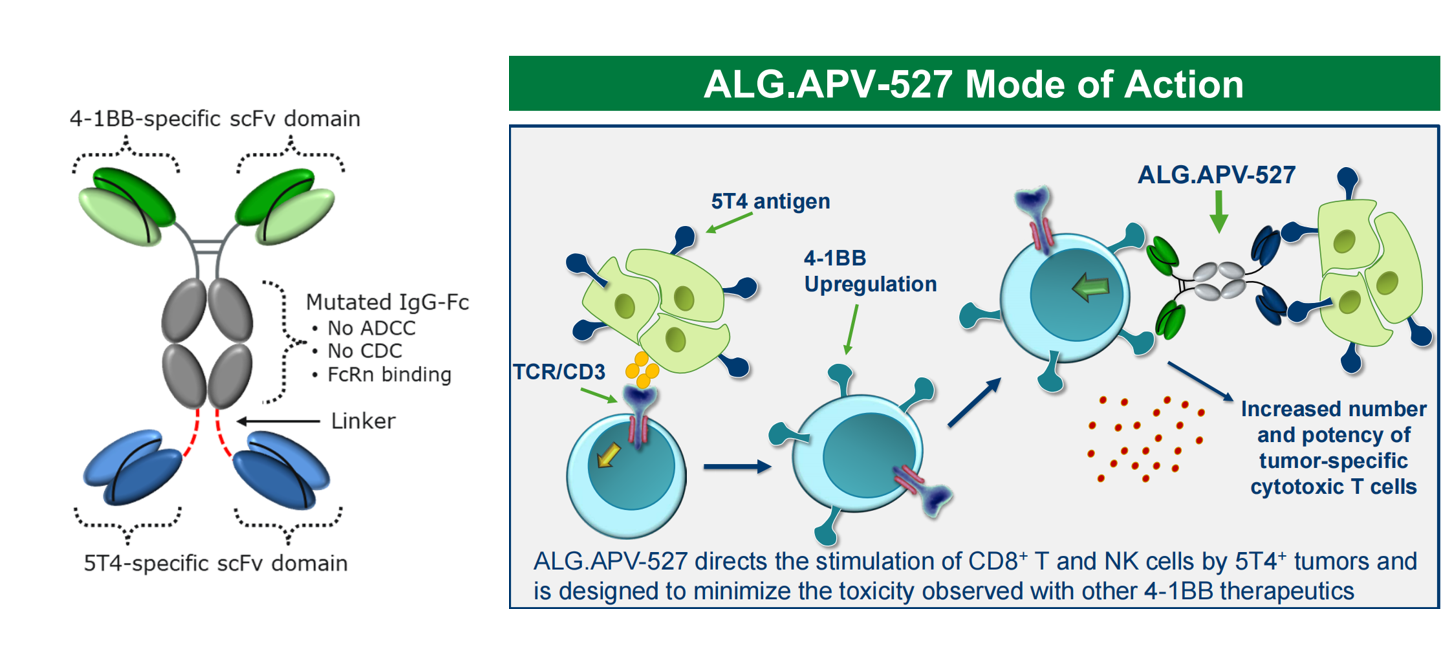
(数据来源 Aptevo官网)
我们收集整理一批TPBG相关抗体序列信息。文档可关注公众号,号内回复“ TPBG ”下载。
