LILRB2(Leukocyte Immunoglobulin-Like Receptor B2)是一种免疫检查点分子,属于LILR家族的一员,主要表达于髓系细胞(如单核细胞、巨噬细胞、树突状细胞)和某些肿瘤细胞59。它通过与配体(如HLA-G、ANGPTLs、SEMA4A和CD1d)结合,传递抑制性信号,抑制免疫细胞的活性,促进肿瘤免疫逃逸。
LILRB2的表达分布
LILRB2在具有免疫调节作用IL-10产生的致耐受性的树突状细胞中表达。在孕期的髓源性抑制细胞中表达。在自然杀伤(NK)细胞中检测到低水平表达。在B细胞中也有表达。
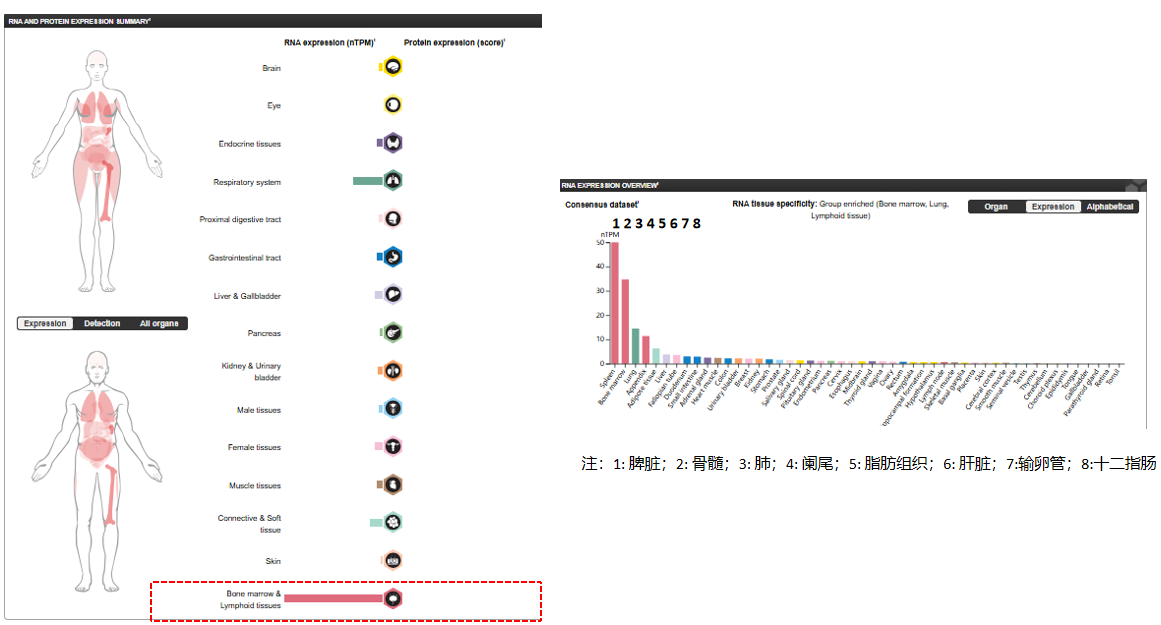
(数据来源 uniprot)
LILRB2的功能
a)维持免疫耐受和自身稳定:识别正常细胞表面的MHC-I分子(“自我”信号),传递抑制信号,防止巨噬细胞、树突状细胞过度激活或攻击自身组织。b)抑制炎症反应:在感染或炎症环境中,配体结合LILRB2可抑制髓系细胞的活化、细胞因子的产生(如TNF-α,IL-12)和共刺激分子的表达,从而负向调节炎症反应,防止组织损伤。c)促进肿瘤免疫逃逸:肿瘤细胞通常高表达MHC-I类分子(包括HLA-G)。这些分子与肿瘤浸润髓系细胞(如肿瘤相关巨噬细胞-TAMs,髓源性抑制细胞-MDSCs)上的LILRB2结合。d)调控抗原提呈细胞功能:抑制树突状细胞的成熟和活化,降低其刺激T细胞的能力,促进免疫耐受。
LILRB2的结构
LILRB2是由LILRB2基因编码的长度为597 AA,分子量约65 kDa的Ⅰ型跨膜蛋白,包含胞外区、跨膜区和胞内区结构域,是一种关键的抑制性免疫受体,其结构特点是胞外4个Ig样结构域结合MHC-I配体,胞内依赖ITIM基序招募SHP-1/SHP-2磷酸酶。
胞外区(22-460 aa):包含4个Ig-like C2-type 1样结构域(D1,D2,D3,D4);D1和D2结构域主要负责与配体结合。主要识别并结合经典的MHC-I类分子(如HLA-A,-B,-C)和非经典的MHC-I类分子(如HLA-G)。这种结合是LILRB2发挥免疫抑制功能的基础。
跨膜区(461-481 aa):包含一个带正电荷的氨基酸残基(Lys残基),该残基与与带负电荷的接头蛋白DAP12(DNAX-activating protein of 12 kDa)形成复合物;LILRB2本身没有内在的信号基序,需要DAP12来传导信号。
C末端胞内域(482-597 aa):包含多个丝氨酸/苏氨酸磷酸化位点,可能参与与其他信号蛋白或支架蛋白的相互作用。包含2个或4个(取决于剪接变体)免疫受体酪氨酸抑制基序。ITIM是其核心功能域。当LILRB2与配体(如MHC-I)结合后,ITIM中的酪氨酸残基会被Src家族激酶磷酸化。磷酸化的ITIM招募并激活含有SH2结构域的酪氨酸磷酸酶,主要是SHP-1和SHP-2。
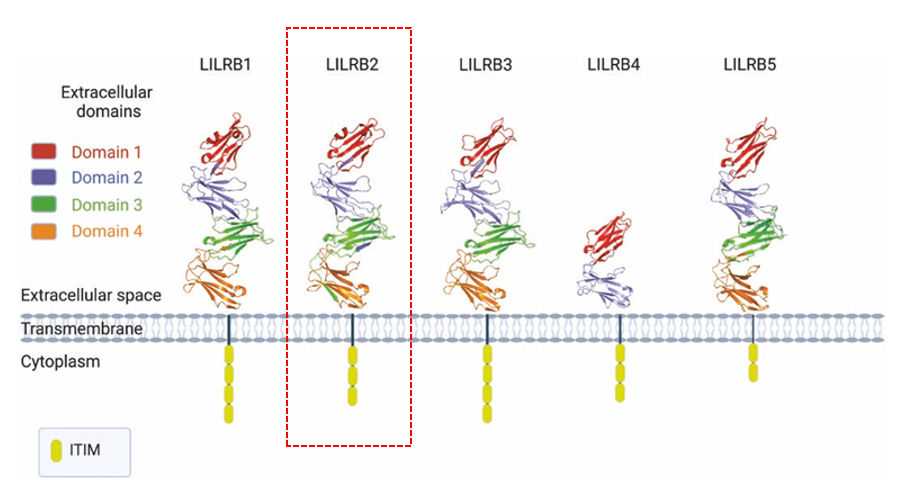
(数据来源:Gomes R, et al. Immunother Adv. 2025)
LILRB2的信号通路
ITIM-SHP磷酸酶通路:a)配体结合:当LILRB2与配体(如MHC-I、HLA-G等)结合后,ITIM基序中的酪氨酸残基被Src家族激酶磷酸化;b)磷酸酶招募:磷酸化的ITIM招募含SH2结构域的酪氨酸磷酸酶SHP-1(PTPN6)和SHP-2(PTPN11);c)下游信号抑制:SHP-1/2通过去磷酸化作用抑制激活信号通路(如Syk、PI3K/AKT、MAPK通路),阻断免疫细胞(如巨噬细胞、树突状细胞)的活化、吞噬功能及炎症因子释放。而在血小板中,抑制胶原受体GPVI和整合素αⅡbβ3信号,减少LAT、SLP76和PLCγ2的磷酸化,从而抑制血栓形成。
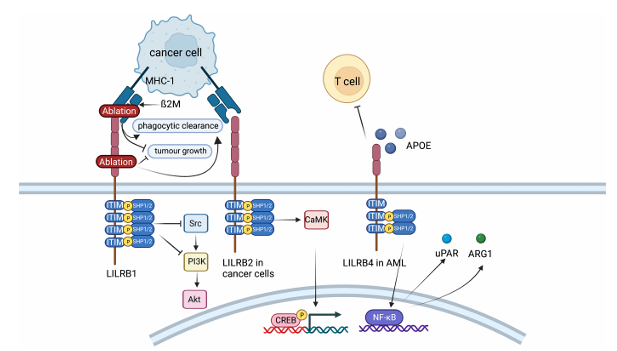
(数据来源:Qian Y, et al. Chin J Cancer Res. 2022)
LILRB2与疾病
肝纤维化(hepatic fibrosis):高脂饮食下肝细胞分泌的ANGPTL8,结合肝星状细胞表面LILRB2激活ERK1/2信号,经TGFβ1正反馈、自噬调控,促进α-SMA和CollagenⅠ等纤维化基因表达诱导肝纤维化,二甲双胍可抑制ANGPTL8阻断该过程。

(数据来源:Zhang Z, et al. J Adv Res. 2023)
肺癌(lung cancer):放射治疗诱导cGAS-STING通路激活后,在非小细胞肺癌中引发LILRB2表达上调,进而促进P16依赖性细胞衰老及衰老相关分泌表型(SASP)。该级联反应最终激活NSCLC中的JAK2/STAT3信号通路,从而推动肿瘤进展并增强放射抵抗性。从治疗视角看,将LILRB2阻断疗法与放射治疗联用,有望提升抗肿瘤疗效并延长患者生存期。
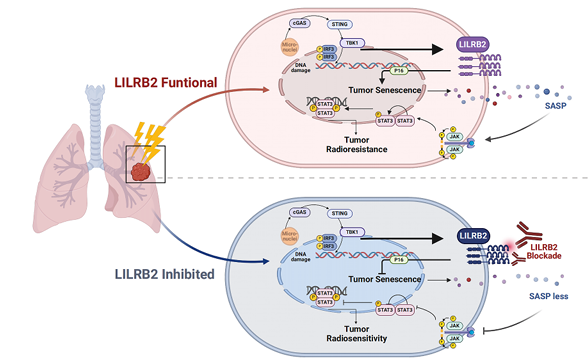
(数据来源:Chen X, et al.Cancer Lett. 2024)
乳腺癌(breast cancer):LILRB2在乳腺癌组织及细胞中表达上调,且与不良预后呈正相关。该受体通过下调HLA-A表达促进乳腺癌进展。其作用机制为:LILRB2促进泛素连接酶膜相关环指蛋白9(MARCH9)与HLA-A的相互作用,从而介导HLA-A的泛素化修饰及后续降解。在同源移植小鼠模型中,表达LILRB2的乳腺癌细胞成功逃逸CD8+T细胞的杀伤,并抑制细胞毒性CD8+T细胞的细胞因子分泌。
阿尔茨海默病(AD):LILRB2(人源)或其鼠源同源蛋白PirB是β-淀粉样蛋白(Aβ)寡聚体的高亲和力受体。两者结合后激活下游信号,导致丝切蛋白(cofilin)信号增强,破坏神经元肌动蛋白细胞骨架,损害突触可塑性与树突棘结构,最终引发认知障碍和记忆缺失。
LILRB2的靶向治疗
MK-4830是由Agenus, Inc.研发的一款靶向LILRB2的单克隆抗体药物。其主要的作用机制是作为LILRB2的抑制剂,用于治疗卵巢癌和晚期头颈部鳞状细胞癌。于2020年6月26日批准2期临床试验。
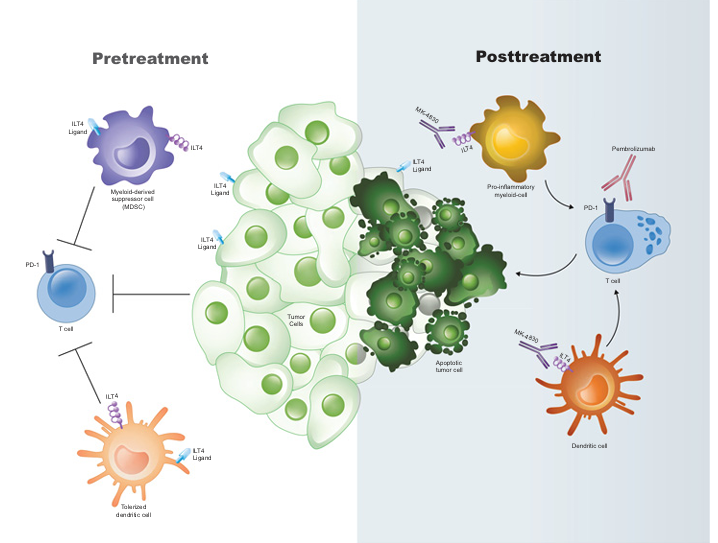
(数据来源:Siu LL, et al.Clin Cancer Res. 2022)
OR502是由OncoResponse, Inc研发的一款靶向LILRB2的单克隆抗体药物。其主要的作用机制是作为LILRB2的调节剂,用于治疗晚期恶性实体瘤和皮肤黑色素瘤。于2023年10月24日批准2期临床试验。
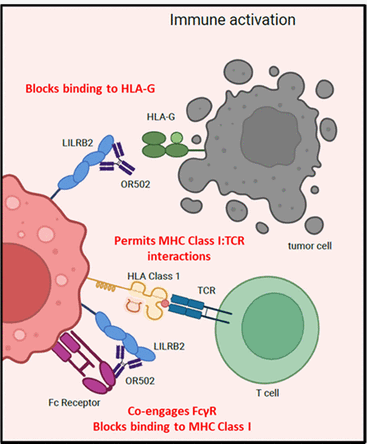
(数据来源:Shiraj Sen, et al.Clinical Trial Completed. 2024)
IO-108是由Immune-Onc Therapeutics研发的一款靶向LILRB2单克隆抗体药物。其主要的作用机制是作为LILRB2的抑制剂,用于治疗实体瘤。于2021年9月30日批准1期临床试验。
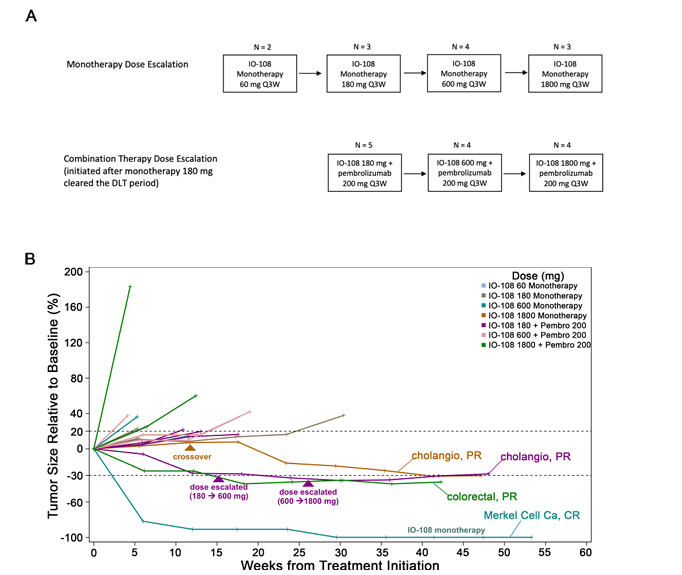
(数据来源:Shiraj Sen, et al.Clinical Trial Completed. 2024)
Anti-LILRB2 nanobody (CN114805568A)是由北京科诺信诚科技有限公司研发的一款靶向LILRB2的纳米抗体药物。其主要的作用机制是作为LILRB2的抑制剂,用于治疗实体瘤。目前处于临床前阶段。
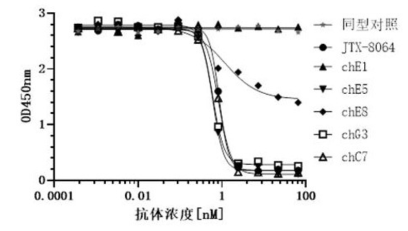
(数据来源:国家知识产权局)
我们收集整理一批LILRB2相关抗体序列信息。文档可关注公众号,号内回复“ LILRB2 ”下载。
