服务支持
迈思生物承担了该研究中活性蛋白ZBP1的定制开发。

背景

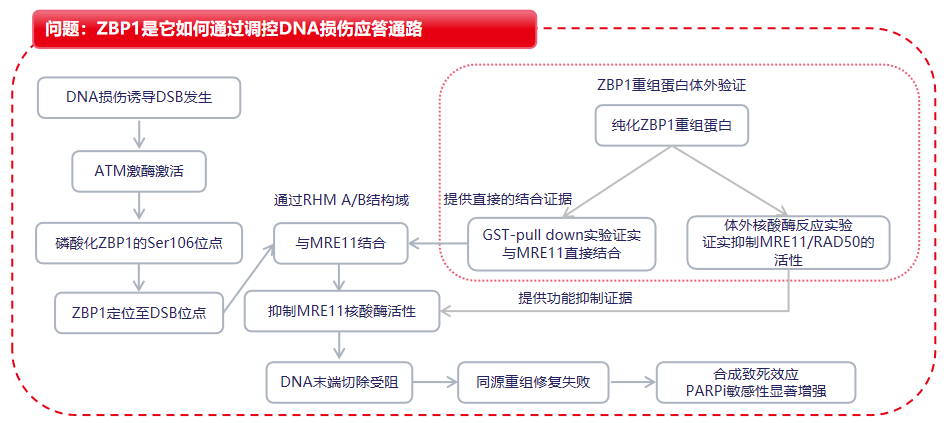
基因组不稳定性作为癌症的典型特征,其根源在于DNA损伤反应(DDR)的缺陷。在癌细胞中,DNA双链断裂(DSBs)是威胁基因组完整性的主要损伤源,DSBs的修复主要通过两种机制:非同源末端连接(NHEJ)和同源重组(HR)。多种模式识别受体(PRRs),包括cGAS、AIM2、DHX9、RIG-I、ZBP1等,能够识别胞质核酸(cNA),激活胞质免疫通路,从而诱导干扰素(IFN)生成并引发促炎反应。ZBP1是一种经典的模式识别受体(PRR),参与调节程序性细胞死亡和固有免疫应答。然而,ZBP1在细胞核中的作用仍未明确。目前尚不清楚ZBP1是否与其他模式识别受体以类似方式影响DNA损伤反应(DDR)。

2025年10月28日华中科技大学同济医学院附属同济医院妇产科团队在Drug Resistance Updates上发表了一篇名为“ZBP1 antagonizes MRE11-mediated DNA end resection and confers synthetic lethality to PARP inhibition in ovarian cancer ”的研究,本研究揭示了ZBP1在DNA双链断裂(DDR)修复中的调控机制。当外源性DNA损伤被诱导时,核内ZBP1会聚集在双链断裂位点,并被ATM激酶在丝氨酸106位点磷酸化。磷酸化的ZBP1随后与MRE11结合,阻止下游末端切除反应,从而阻断同源重组(HR)修复。研究发现,卵巢癌患者中ZBP1高表达水
平与多聚ADP核糖聚合酶(PARP)抑制剂的合成致死效应敏感性显著相关,这种药物在HR缺陷型肿瘤中疗效更佳。
研究结果
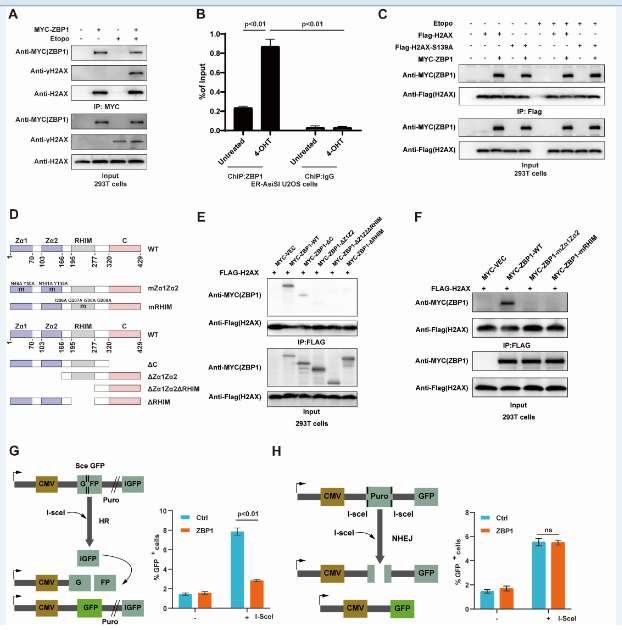
通过免疫共沉淀(Co-IP)、染色质免疫沉淀(ChIP)、构建ZBP1截短体和点突变,免疫荧光等实验,结果表明ZBP1参与并负调控DNA双链断裂(DSB),ZBP1被招募到DSB位点,并特异性抑制HR修复途径。ZBP1通过抑制DNA末端切除来阻碍HR。
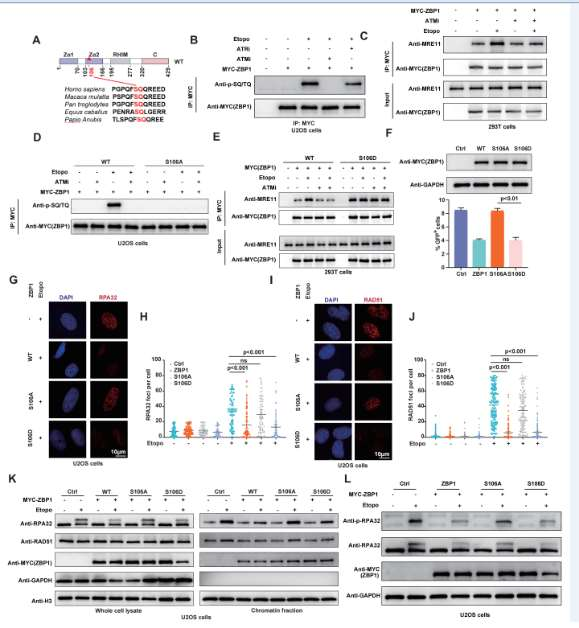
通过Co-IP、GST Pull-Down、体外核酸酶活性实验,发现ZBP1通过直接结合MRE11并抑制其核酸酶活性,从而抑制DNA末端切除。ATM介导的ZBP1磷酸化调控其与MRE11的结合及HR抑制功能。
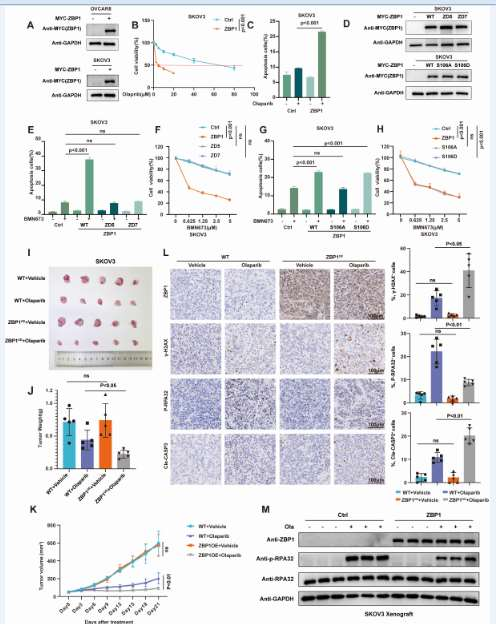
通过在卵巢癌和乳腺癌细胞中过表达ZBP1,进行CCK-8细胞活力检测和Annexin V流式细胞术凋亡检测;建立小鼠皮下移植瘤模型。发现ZBP1通过抑制HR,在体外和体内均赋予肿瘤对PARP抑制剂的合成致死敏感性。ZBP1可作为预测卵巢癌患者对PARP抑制剂治疗响应的潜在生物标志物。
总结
在DNA损伤后,ZBP1被ATM磷酸化,进而直接结合MRE11并抑制其核酸酶活性,最终抑制DNA末端切除和HR修复。这一机制的发现,不仅解释了ZBP1高表达为何能增强PARP抑制剂疗效,更重要的是确立了ZBP1作为预测PARP抑制剂反应的潜在生物标志物,为卵巢癌的精准治疗提供了新的理论基础和临床策略。

